När används beräknat LDL? #
Denna formel används allt mer sällan eftersom direkt mätning av LDL kolesterol är mer exakt och metoden finns tillgänglig på i princip samtliga laboratorier som analyserar lipider. Metoden kräver att triglycerider mäts i fasta. Fasteprov är inte nödvändigt för att få ett korrekt LDL-värde vid direkt mätning av LDL. Friedwalds formel används för att göra beräkningen och formeln ger osäkra resultat vid mycket höga värden på triglycerider eller totalkolesterol.
LDL = totakolesterol – HDL – (triglycerider / 2.2)
Betydelsen av LDL-kolesterol vid aterosklerotisk kardiovaskulär sjukdom – en översikt för läkare #
Lågdensitetslipoprotein-kolesterol (LDL-C) har sedan lång tid betraktats som ett centralt mått på aterogen lipoproteinexponering och är starkt kopplat till utvecklingen av aterosklerotisk kardiovaskulär sjukdom (ASCVD). Den så kallade “lipidhypotesen” postulerar att förhöjda nivåer av LDL-C är orsak till koronar hjärtsjukdom, stroke och perifer arteriesjukdom. Nyare genetiska studier, randomiserade interventionsstudier och meta-analyser har i hög grad bekräftat detta orsakssamband. För läkaren är det därför av stor betydelse att förstå hur LDL-C bidrar till aterogenes, vilka evidensbaserade mål som finns, samt hur detta påverkar primär- och sekundärpreventiv behandling.
Patofysiologi
LDL-partiklar transporterar kolesterol från levern till perifera vävnader och utgör den viktigaste transportformen för kolesterol i plasma. Vid förhöjd LDL-C ökar koncentrationen av apoB-innehållande lipoproteiner (främst LDL, men även VLDL-remnantpartiklar) i cirkulationen. Dessa partiklar kan penetrera intima i artärväggen, särskilt vid lokal endothelial dysfunktion och lågt skjuvstress, och fastna där genom bindning till proteoglykaner och andra matrixkomponenter (“retention hypothesis”). När dessa partiklar ackumuleras, oxideras eller modifieras, attraheras monocyter/macrofager som fagocyterar dem och bildar skumceller. Detta initierar en inflammatorisk process med fibros, kärlväggsförändringar och så småningom uppbyggnad av aterosklerotiska plack. Ju högre och längre tid exponeringen av LDL-C är, desto större blir den kumulativa aterogena “skulden”. Detta har gett upphov till begreppet “exponeringstid × nivå” vilket är centralt vid riskbedömning.
Evidens för orsakssamband
- Epidemiologiska data visar att högre nivåer av LDL-C är linjärt associerade med högre risk för koronarsjukdom, stroke och andra aterosklerotiska händelser. En studie i The Lancet visade att även hos individer 70–100 år med förhöjt LDL-C var absolut risk för myocardial infarction hög och nyttan med behandling tydlig.
- Mendelska randomiseringsstudier visar att genetiskt betingade högre LDL-C ger ökad ASCVD-risk, vilket förstärker tolkningen att LDL-C är orsak snarare än enbart markör.
- Interventionsstudier har visat att sänkning av LDL-C minskar risken för kardiovaskulära händelser. Till exempel visade meta-analys att varje 1 mmol/L (≈39 mg/dL) sänkning av LDL-C ger drygt 20 % relativ riskreduktion vad gäller stora kardiovaskulära händelser.
- Senare data visar även att “ju lägre desto bättre” för LDL-C – det verkar inte finnas ett tydligt nedre gränsvärde där ytterligare sänkning inte för med sig ytterligare nytta.
Målvärden
Internationella och europeiska riktlinjer (bl.a. European Society of Cardiology, American Heart Association/American College of Cardiology) anger målnivåer för LDL-C beroende på riskkategori:
- Vid mycket hög risk (t.ex. etablerad ASCVD) rekommenderas lägsta möjliga LDL-C (< 1.4 mmol/L eller < 55 mg/dL) och/eller ≥50 % reduktion från utgångsnivå.
- Vid primärprevention eller måttlig risk är målet ofta något högre, t.ex <2.6 mmol/L (<100 mg/dL).
Detaljer om målvärden i specifika patientgrupper diskuteras nedan.
Praktiska rekommendationer
- Vid utvärdering av lipider bör LDL-C vara en central parameter för bedömning av aterosklerotisk risk.
- I fall med förhöjd LDL-C bör man tänka på tidsexponering – hur länge patienten haft hög nivå – samt övriga riskfaktorer såsom hypertension, diabetes, rökning och inflammatorisk status.
- Behandlingsstrategi omfattar livsstilsförändringar (kost, fysisk aktivitet, rökstopp, viktreduktion) samt farmakologisk intervention (statiner, ezetimib, PCSK9-hämmare) baserat på risknivå och målnivåer för LDL-C.
- Uppföljning av LDL-C bör ske regelbundet för att utvärdera behandlingssvar och eventuella behov av intensifiering. Real-world-data visar att många patienter inte når målet – vilket motiverar att granska behandlingsupplägg och följsamhet.
- Hos patienter med residual risk trots låg LDL-C bör man beakta andra aterogena lipider eller faktorer (t.ex. Lp(a), triglyceridrika lipoproteiner) men detta ska inte avleda uppmärksamheten från LDL-C som primär målparameter.
Begränsningar och särskilda överväganden
- LDL-C är ett centralt mått men inte heltäckande: partikelantal (apoB) och partikelstorlek (små täta LDL) kan ge ytterligare prognostisk information. En studie visade att ökat antal LDL-partiklar samt små täta LDL var associerade med högre CVD-risk oberoende av LDL-C nivå.
- Hos mycket avancerad sjukdom eller multikomorbiditet blir möjligheten att drastiskt sänka risk via LDL-C begränsad – kompletterande insatser krävs.
- Behandlingsmål måste anpassas till individen: högre risk kräver aggressivare strategi, och behandlingsrisker (t.ex. statinbiverkningar) måste vägas.
- Vid extremt låg LDL-C nivå bör säkerhetsaspekter övervägas – även om data hittills inte visat allvarliga problem med mycket låg LDL-C.
- Patientens följsamhet, läkemedelsinteraktioner, sekundära orsaker till dyslipidemi (t.ex. njursjukdom, hepatisk sjukdom, hormonella tillstånd) måste alltid undersökas.
Betydelsen av LDL-C efter akuta koronara syndrom #
Efter ett akuta koronara syndrom (AKS) befinner sig patienten i en betydligt högre riskzon för recidiv av aterosklerotiska händelser, såsom reinfarkt, stroke eller kardiovaskulär död. Evidens visar att nivån av LDL-C är direkt korrelerad med risken för framtida händelser, och att tidig aggressiv sänkning av LDL-C (“the lower the better” och “strike early and strike strong”) ger bättre prognos. Guidlinjer från European Society of Cardiology/European Atherosclerosis Society (ESC/EAS) och andra expertpaneler rekommenderar därför behandling utformad utifrån erhållen LDL-C och mål för denna.
Vid AKS bör behandling med lipidsänkande läkemedel startas som regel under vårdtiden, oavsett initial LDL-C-nivå, med ambition att snabbt nå riktade nivåer.
Behandlingsmål för LDL kolesterol
Efter AKS och vid etablerad aterosklerotisk kardiovaskulär sjukdom (ASCVD) rekommenderas målnivåer för LDL-C enligt riskkategori. Ett urval av viktiga riktlinjer och målnivåer:
- Vid mycket hög risk (inklusive AKS) är målet för LDL-C < 1,4 mmol/L (~55 mg/dL) och minst ≥50 % reduktion från baslinjen.
- För patienter med mycket hög risk och återinsjuknande händelse inom 2 år trots maximal behandling kan ännu lägre mål (<1,0 mmol/L) övervägas.
Behandlingsalgoritm för kolesterolsänkande läkemedel
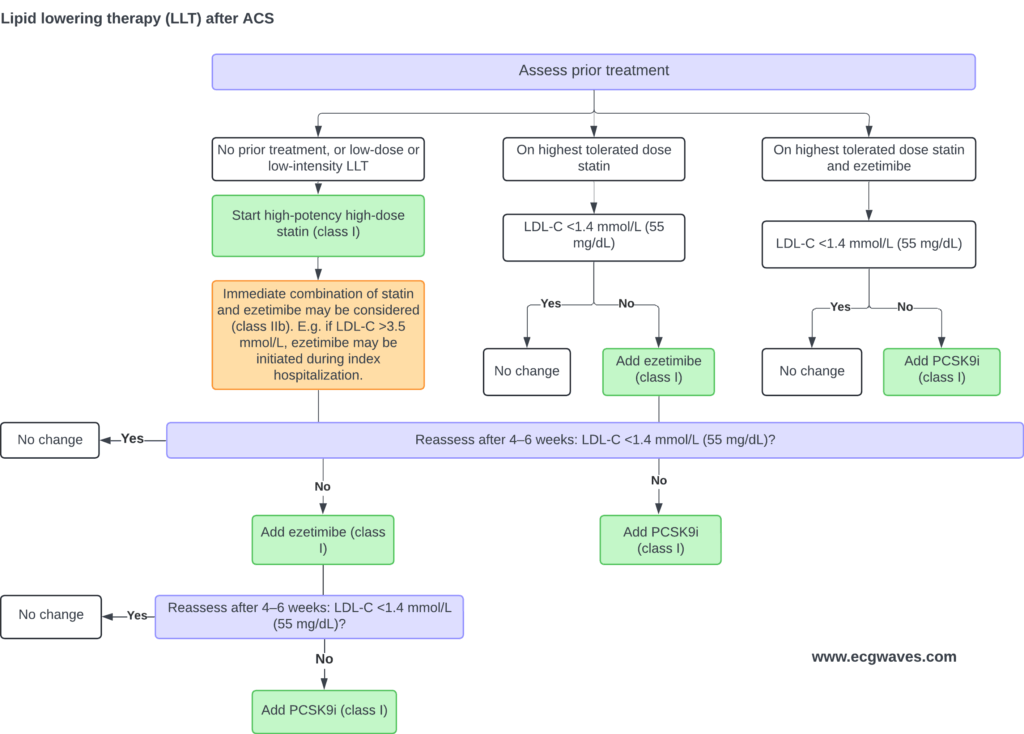
När man planerar behandlingen av dyslipidemi efter AKS med inriktning på LDL-C bör följande steg beaktas.
1. Statinbehandling – förstahandsval
Hos patienter med AKS rekommenderas högintensiv statinbehandling som första linje, oberoende av initial LDL-C-nivå. Det handlar både om “priming” av behandling och snabb sänkning. Statiner minskar produktionen av kolesterol i levern och uppreglerar LDL-receptorer, vilket minskar LDL-C.
Vid uppföljning (vanligen 4–8 veckor efter insättning) utvärderas om målet för LDL-C uppnåtts. Om inte – gå vidare med nästa steg.
2. Tillägg av Ezetimib
Om statinbehandling, även vid max tolererad dos, inte leder till målnivå för LDL-C, rekommenderas tillägg av ezetimib. Denna läkemedel hämmar intestinal absorption av kolesterol och ger ytterligare LDL-C-sänkning. I artiklar rapporteras att statin + ezetimib tidigt efter AKS leder till bättre LDL-C-måluppfyllelse.
3. PCSK9-hämmare
Om målet fortfarande inte uppnåtts efter maximalt tolererad statin + ezetimib, bör en PCSK9-hämmare övervägas. Dessa läkemedel (t.ex. alirokumab, evolokumab, inklisiran) blockerar PCSK9-proteinet vilket leder till ökad återvinning av LDL-receptorer och markant LDL-C-sänkning (~50-60 % eller mer) hos många patienter.
I riktlinjer för AKS framhålls att hos patienter med LDL-C ≥ 1,8 mmol/L (≈70 mg/dL) trots maximalt behandling bör PCSK9-hämmare övervägas.
När ska man intensifiera och hur bestämmer man behandlingsval?
Uppföljning
Efter AKS och initiering av lipidbehandling:
- Kontrollera lipidprofil (inklusive LDL-C) 4–8 veckor efter insättning eller ändring av behandling.
- Kontroller därefter var 6–12 månad eller oftare om behandling ändras.
- Om behandling intensifieras – följ upp efter ytterligare 4–6 veckor för att bedöma svarsgrad och överväga nästa steg.
- Dokumentera nivå och förändring (%-reduktion) mot mål: många riktlinjer anger att minst 50 % reduktion från baslinjen är ett behandlingsmål vid AKS.
- Bedöm även förekomst av sekundära orsaker till högt LDL-C (t.ex. familjär hyperkolesterolemi, hypothyreos, nefrotiskt syndrom) om målet inte nås.
