De mekanismer som driver koronar och cerebral perfusion samt ventilation i lungorna under hjärt-lungräddning (HLR) skiljer sig avsevärt från normalfysiologiska mekanismer. Syftet med HLR är att variera tryckförhållandena i thorax genom att komprimera, dekomprimera och ventilera. Dessa tre manövrer resulterar i att blod flödar i anterograd riktning genom lungor, hjärta och hjärna, samt att gasutbyte sker i lungorna.
Ett stort antal experimentella och kliniska studier har genomförts (och fler pågår) för att optimera effektiviteten vid HLR. När HLR utförs effektivt kan an åstadkomma en cardiac output motsvarande 15–25% av normal cardiac output (Duggal et al). Detta är, tillsammans med defibrillering, tillräckligt för att återuppliva 10–15% av hjärtstopp som inträffar utanför sjukhus och 30–40% av hjärtstopp på sjukhus (Jerkeman et al). I dagsläget anses att ett kompressionsdjup på 5-6 cm och hastighet på 100-120 kompressioner/minut är optimalt (Figur 1).

Vänster: Sambandet mellan kompressionsdjup och överlevnad tll utskrivning från sjukhus (Stiell et al). Höger: Sambandet mellan kompressionsfrekvens och överlevnad till utskrivning från sjukhus (Idris et al).
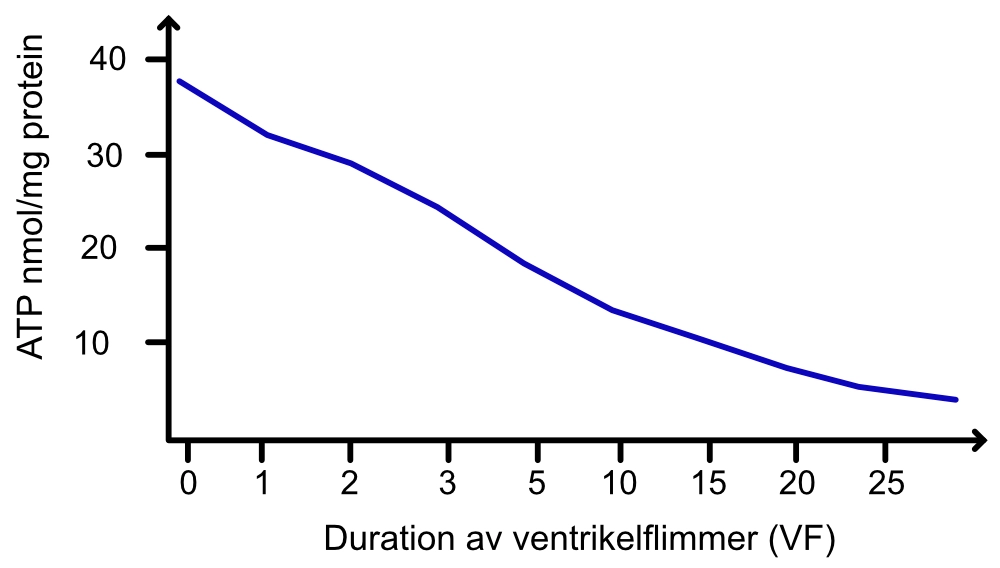
Om den initiala rytmen vid ett hjärtstopp är defibrillerbar (ventrikelflimmer [VF], ventrikeltakykardi [VT]) är defibrillering den viktigaste åtgärden. Som tidigare diskuterat är ventrikelflimmer inledningsvis grovvågigt (kraftiga amplituder) men blir allteftersom mer finvågigt (lägre amplituder). Detta är troligtvis ett resultat av snabbt minskande koncentration av energi (ATP-molekyler) i myokardcellen under VF. Möjligheten att defibrillera ett grovvågigt ventrikelflimmer är många gånger högre än ett finvågigt ventrikelflimmer. I de fall den initiala rytmen inte är defibrillerbar är syftet med hjärt-lungräddning att snarast möjligt inducera elektrisk aktivitet i hjärtat, så att hjärtat kan startas och därmed rädda hjärnan.

Den enskilt viktigaste åtgärden vid ett hjärtstopp (när omedelbar defibrillering inte är möjlig) är bröstkompressioner. Kompressionerna resulterar i att blod cirkulerar i lungorna, hjärtat och hjärnan. Detta sker genom att trycket i samtliga hjärtrum ökar under kompressionen, vilket leder till att blod drivs framåt (förutsatt att klaffarna är kompetenta). Tyvärr leder kompressionen även till stegrat tryck i thorakala vener som dränerar hjärnan. Det stegrade trycket i thorakala vener fortplantas till hjärnan och motverkar cerebralt arteriellt bodflöde. Detta är en av de stora utmaningarna för forskare inom detta område.

Kompressionsfasen
Bröstkompressioner ökar trycket och minskar volymen i thorax. Detta leder till tryckstegring och kompression av alla strukturer, inklusive förmak, kammare, luftvägar och de stora kärlen. Detta leder till att blod forceras framåt i riktning mot hjärnan, hjärtat och lungorna. Hjärtats klaffar förhindrar lyckligtvis blod från att pressas ut i vena cava superior et inferior. Om blod hade pumpats dit skulle pumpmekanismen vara betydligt sämre eftersom venös tryckstegring hade motverkat arteriellt blodflöde.
När bröstkorgen komprimeras stiger trycket i hela thorax, inklusive i lungor, förmaken, kamrarna och de stora kärlen (aorta, lungartären, lungvenerna). Kompressionen leder till att hjärtat komprimeras mellan sternum och kotpelaren. Om hjärtklaffarna fungerar normalt kommer blod flöda i anterograd riktning så att lungor, hjärta och hjärna perfunderas. Blodet som forceras ut i aorta kommer även perfundera kranskärlen, vilket är fundamentalt för att återfå kardiell elektrisk aktivitet. Perfusionstrycket i kranskärlen (CPP, coronary perfusion pressure) kan beräknas genom följande formel:
CPP = PAorta – RAP
PAorta är trycket i aorta (där kranskärlen avgår)
RAP är right atrial pressure (trycket i höger förmak, där kranskärlens venösa blod töms).
Under kompressionen är CPP ungefär 0 mmHg, vilket innebär att koronar perfusion är obefintlig.
CPP måste vara >15 mmHg för att kunna inducera elektrisk aktivitet i myokardiet (Paradis et al). Tryckstegringen under kompressionen är ungefär lika stor i alla hålrummen (tryckstegringen är något högre i höger förmak och höger kammare). Detta påverkar dock inte CPP eftersom flödet i kranskärlen sker under ”diastole”, vilket är dekompressionen (Figur 3). Det är således tryckskillnaden i aorta och höger förmak under dekompressionen som styr CPP. Under dekompressionen vidgas thorax fort och aortaklaffen stänger. Klaffens stängning leder till att trycket i aorta fortsätter vara högt under dekompressionen, medan trycket i samtliga hålrum minskar fort när de expanderar. Tryckminskningen i höger förmak är viktig eftersom skillnaden i tryck mellan höger förmak och aorta är ekvivalent med CPP. Tryckminskningen leder också till passivt flöde av blod tillbaka till förmak och kammare (Halperin et al).

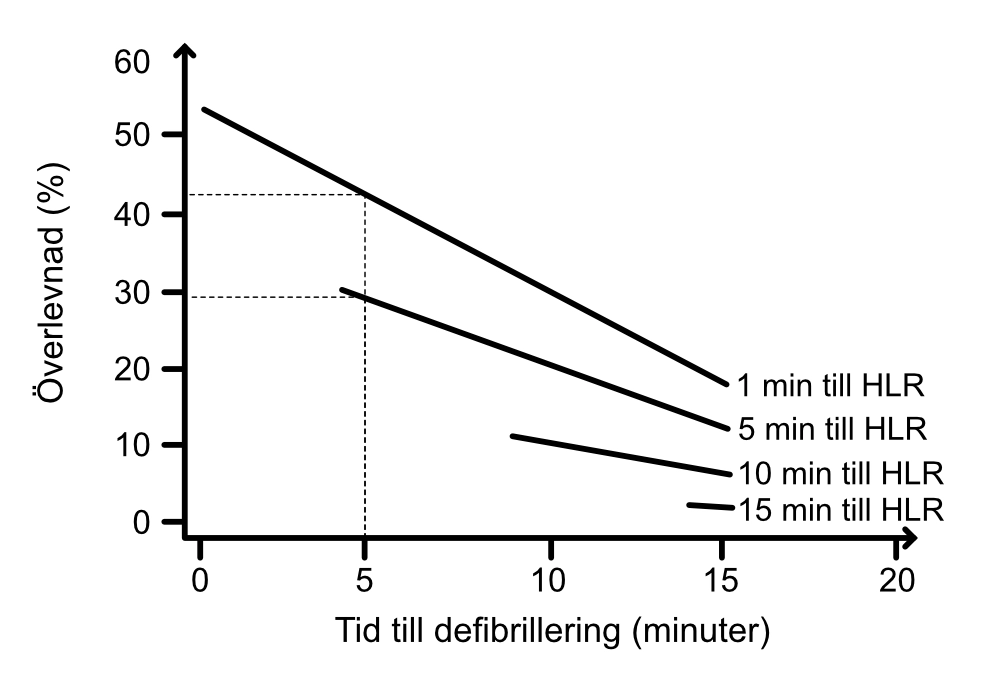
CPP är mycket känsligt för avbrott i kompressionerna. Ett kortare avbrott (ett par sekunder) leder till att CPP upphör och det krävs upp mot 15 kompressioner igen för att återfå CPP som förelåg innan avbrottet (Steet et al, Berg et al). Överlevnaden minskar med 7% för var 5:e sekund paus innan defibrillering. Den skadliga effekten av paus efter defibrillering är ungefär lika stor (Cheskes et al).
Kraftfullare kompressioner ger en kraftigare pumpmekanism som driver blodflöde i hjärta och hjärna. Likaledes är en kraftig dekompression essentiell för att bygga upp CPP och maximera passivt återflöde till hjärtat (Niemann et al).
Flödet i kranskärlen drivs av att trycket i aorta blir högt under kompressionsfasen och förblir högt under dekompressionen eftersom aortaklaffen stänger.
Kompressionerna leder även till tryckstegring i venerna i thorax (v. cava superior, paravertebrala vener, epiduralvener) och spinalvätskan. Denna tryckstegring fortplantas dessvärre upp till hjärnan och leder till venös tryckstegring, vilket leder till högre intrakraniellt tryck (ICP, intracranial pressure). Högt intrakraniellt tryck motverkar det cerebrala perfusionstrycket (CerPP, cerebral perfusion pressure). Således leder kompressionerna till ökat intrakraniellt tryck (ICP), vilket reducerar cerebral perfusion (CerPP). Trots detta är det essentiellt att bygga upp högt CPP eftersom det krävs för att återfå kardiell aktivitet.
Under kompressionsfasen sker passiv expiration eftersom lungvävnaden (inklusive alveolerna) komprimeras under denna fasen.
Aktuella riktlinjer rekommenderar ett kompressionsdjup på 5-6 cm, med en hastighet på 100–120 kompressioner per minut (Figur 1). Detta härrör från en observationsstudie på cirka 4000 individer där man noterade att en frekvens på 110–120 var associerat med högst överlevnad (Idris et al). Denna generella rekommendation är sannolikt inte optimal för alla individer men används i frånvaro av verktyg och evidens som möjliggör respektive föreslår annat. Cardiac output blir lägre om kompressionerna är för långsamma eller för snabba.
Dekompressionsfas
Under dekompressionen sker en passiv rekyl av thorax. Detta leder till en snabb tryckminskning i hela thorax. I lungorna skapas ett vakuum som drar ner luft i lungorna. Höger och vänster kammare fylls med blod eftersom tryckminskningen i ventriklarna skapar ett passivt blodflöde. Dekompressionen leder även till lägre ICP (genom samma mekanism som ovan) och faciliterar därmed cerebral perfusion under nästa kompressionsfas.
Interventioner som ökar rekylen (expansion av thorax) resulterar i förbättrad preload (fyllnad) och därmed större slagvolymer under kompressionen. Det pågår utveckling av utrustning vars syfte är att förbättre rekylen genom en aktiv dekompression. Det finns flera varianter av detta, varav sugkoppen på LUCAS är ett exempel på detta.
Att luta sig på bröstkorgen under dekompressionen kan bli fatalt. Djurstudier visar att en rekyl på 75% (jämfört med 100%) minskar CPP med ungefär 30% och CerPP med 50% (Yannopouloset al). Observationsstudier visar att livräddaren lutar på patienten i över 90% av fallen (Fried et al).
Ventilation
Ventilationen under HLR genomförs med hjälp av övertrycksventilation, vilket innebär att luft forceras ner i lungorna. Detta skiljer sig avsevärt från normal respiration. Under normal respiration expanderas thorax genom aktivt arbete av andningsmuskulatur. Detta skapar ett negativt tryck i thorax och luftvägarna (alveolerna). Det negativa trycket utgör ett vakuum som drar ner luft i alveolerna så att gasutbyte kan ske. Den paralyserade andningsmuskulaturen under ett hjärtstopp gör att övertrycksventilation måste användas.
Det finns evidens för att ventilation är mindre viktigt än kompression. Överlevnad är i princip inte möjlig utan kompressioner. Ventilation förefaller kunna åsidosättas under en stund, vilket framgår av studier där man provat compression-only CPR (HLR enbart med kompressioner; Bobrow et al, Svensson et al). I en stor svensk randomiserad studie var det ingen skillnad i överlevnad när bystanders utförde compression-only HLR jämfört med standard HLR vid hjärtstopp utanför sjukhus (Svensson et al). Som framgår ovan resulterar kompressionerna i en viss, om än liten, ventilation (McDannold et al).
Trots ovanstående rekommenderas övertrycksventilation så snart det är möjligt eftersom HLR tappar effekt efter några minuter om inte övertrycksventilation utförs. Detta förklaras av att lungkärlen och bronchioler kollaberar om inte lungorna ventileras (Dunnham-Snary et al). För att vidga lungkärl (artärer och vener) och bronchioler måste övertrycksventilation utföras (Markstaller et al).
Hyperventilation skall alltid undvikas under hjärt-lungräddning. Det förhindrar tryckfallet i thorax, vilket därmed motverkar den passiva fyllnaden. Hyperventilation leder även till stegrade tryck i höger förmak under diastole, vilket reducerar CPP. I en djurstudie minskade CPP med 28% under hyperventilation (Aufderheide et al). Hyperventilation är dessutom onödigt eftersom cardiac output är lågt under HLR, vilket gör att små tidalvolymer räcker för att eliminera CO2 och berika blodet med O2.
Referenser
Duggal C, Weil MH, Gazmuri RJ, Tang W, Sun S, O’Connell F, Ali M. Regional blood flow during closed-chest cardiac resuscitation in rats. J Appl Physiol 1993;74:147–52
Aufderheide TP, Sigurdsson G, Pirrallo RG, et al. Hyperventilation-induced hypotension during cardiopulmonary resuscitation. Circulation 2004;109:1960–5.
Debaty G, Shin SD, Metzger A, Kim T, Ryu HH, Rees J, McKnite S, Matsuura T, Lick M, Yannopoulos D, Lurie K. Tilting for perfusion: head-up position during cardiopulmonary resuscitation improves brain flow in a porcine model of cardiac arrest. Resuscitation 2015;87:38–43
Niemann JT. Differences in cerebral and myocardial perfusion during closed-chest resuscitation. Ann Emerg Med 1984;13:849–53
Halperin HR, Tsitlik JE, Guerci AD, et al. Determinants of blood flow to vital organs during cardiopulmonary resuscitation in dogs. Circulation 1986;73:539–50.
Paradis NA, Martin GB, Rivers EP, et al. Coronary perfusion pressure and the return of spontaneous circulation in human cardiopulmonary resuscitation. JAMA 1990;263:1106–13.
Stiell IG, Brown SP, Christenson J, Cheskes S, Nichol G, Powell J, Bigham B, Morrison LJ, Larsen J, Hess E, Vaillancourt C, Davis DP, Callaway CW; Resuscitation Outcomes Consortium (ROC) Investigators. What is the role of chest compression depth during out-of-hospital cardiac arrest resuscitation? Crit Care Med 2012;40:1192–8 8.
Idris AH, Guffey D, Aufderheide TP, Brown S, Morrison LJ, Nichols P, Powell J, Daya M, Bigham BL, Atkins DL, Berg R, Davis D, Stiell I, Sopko G, Nichol G; Resuscitation Outcomes Consortium (ROC) Investigators. Relationship between chest compression rates and outcomes from cardiac arrest. Circulation 2012;125:3004–12
Cheskes S, Schmicker RH, Verbeek PR, et al. ThE impact of peri-shock pause on survival from out-of-hospital shockable cardiac arrest during the resuscitation outcomes consortium PRIMED trial. Resuscitation 2014;85:336–42.
Bobrow BJ, Spaite DW, Berg RA, et al. Chest compression-only CPR by lay rescuers and survival from out-of-hospital cardiac arrest. JAMA – J Am Med Assoc. 2010;304(13):1447-1454.
Markstaller K, Rudolph A, Karmrodt J, et al. Effect of chest compressions only during experimental basic life support on alveolar collapse and recruitment. Resuscitation. 2008;79(1):125-132.
McDannold R, Bobrow BJ, Chikani V, Silver A, Spaite DW, Vadeboncoeur T. Quantification of ventilation volumes produced by compressions during emergency department cardiopulmonary resuscitation. Am J Emerg Med. 2018;36(9):1640-1644.
Dunham-Snary KJ, Wu D, Sykes EA, et al. Hypoxic Pulmonary Vasoconstriction: From Molecular Mechanisms to Medicine. Chest. 2017;151(1):181-192.
Compression-Only CPR or Standard CPR in Out-of-Hospital Cardiac Arrest List of authors. Leif Svensson, M.D., Ph.D., Katarina Bohm, R.N., Ph.D., Maaret Castrèn, M.D., Ph.D., Hans Pettersson, Ph.D., Lars Engerström, M.D., Johan Herlitz, M.D., Ph.D., and Mårten Rosenqvist, M.D., Ph.D
Steen S, Liao Q, Pierre L, et al. The critical importance of minimal delay between chest compressions and subsequent defibrillation: a haemodynamic explanation. Resuscitation 2003;58:249–58. 19
Berg RA, Sanders AB, Kern KB, et al. Adverse hemodynamic effects of interrupting chest compressions for rescue breathing during cardiopulmonary resuscitation for ventricular fibrillation cardiac arrest. Circulation 2001;104:2465–70.
Yannopoulos D, McKnite S, Aufderheide TP, et al. Effects of incomplete chest wall decompression during cardiopulmonary resuscitation on coronary and cerebral perfusion pressures in a porcine model of cardiac arrest. Resuscitation 2005;64:363–72.
Fried DA, Leary M, Smith DA, et al. The prevalence of chest compression leaning during in-hospital cardiopulmonary resuscitation. Resuscitation 2011;82:1019–24.

