I detta kapitel diskuteras interventioner, metoder och undersökningar som görs under avancerad HLR. Som framgår av Tabell 1 skiljer sig number needed to treat (NNT) för de interventioner som ingår i hjärt-lungräddning. Som framgår av Tabell 1 varierar NNT från 5 (tidig defibrillering) till 112 (adrenalin).
Avancerad HLR ska startas så fort som möjligt vid ett hjärtstopp. Vid hjärtstopp utanför sjukhus görs detta av ambulanspersonal. Avancerad HLR innebär att en avancerad luftväg etableras, defibrillering görs vid VF/VT och läkemedel administreras.
Tabell 1. Number needed to treat för de viktigaste interventionerna
| Åtgärd | NNT för att rädda 1 person | Referens |
|---|---|---|
| Tidig upptäckt av hjärtstopp | 11 | Berdowski et al |
| Bystander HLR | 15 | Hasselqvist et al |
| Tidig defibrillering | 5 | Kitamura et al |
| Adrenalin | 112 | Perkins et al |
- Bröstkompressioner fortsätter som instruerat för Basal HLR, eller med mekanisk HLR (se nedan).
- Patienten skall intuberas eller ventileras effektivt med Rubens blåsa.
- Ventilation sker med 100% syrgas (O2) och 10 inblåsningar per minut.
- Defibrillering ska göras så tidigt som möjligt.

Enligt riktlinjer för hjärtstopp på sjukhus ska HLR startas omedelbart och defibrillering ske inom 180 sekunder (vid VF/VT) efter bekräftat hjärtstopp.
Bröstkompressioner
Detta stycke om bröstkompressioner är en upprepning av samma stycke i kapitlet Basal HLR.
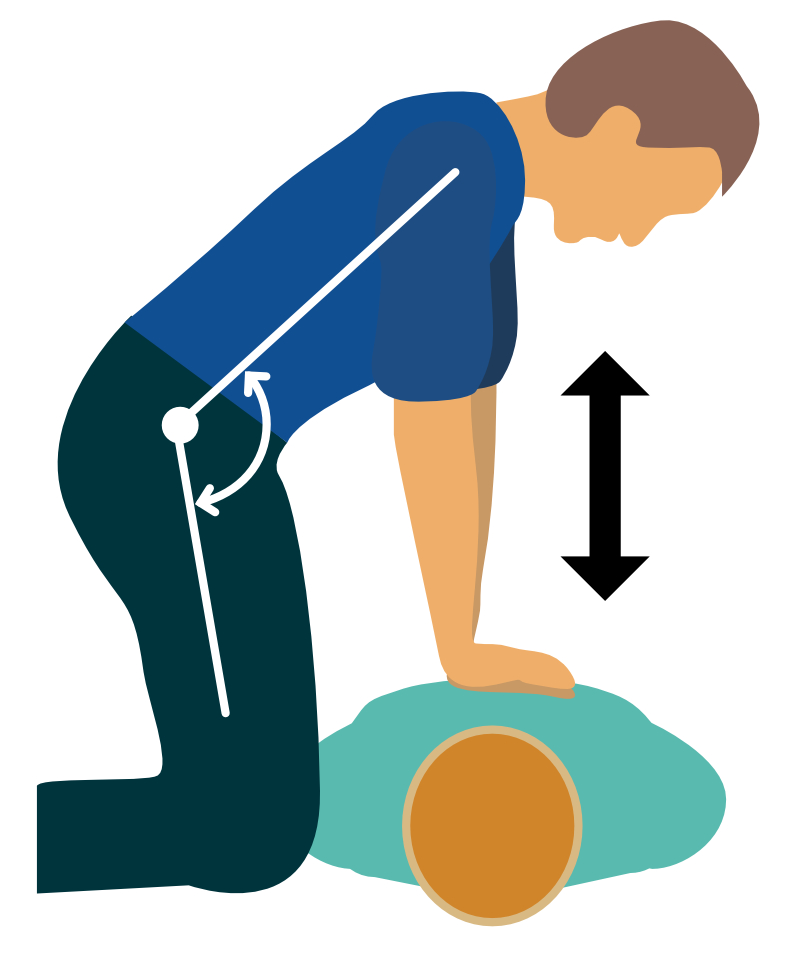
- Placera en hand på nedre halvan av sternum, och placera andra handen på ovansidan av första handen.
- Tryck ner bröstkorgen med raka armar. Böj inte i armbågen. Kompressionsarbetet ska utföras med rygg och bålmuskulatur, vilket möjliggör mer effektiva kompressioner.
- Hastigheten är 100 till 120 kompressioner per minut.
- Sternum ska tryckas ner 5-6 cm.
- Efter varje kompression skall sternum släppas upp fort och fullständigt.
Kompressions-Ventilationskvot
- Vuxna: 30:2 (30 kompressioner följt av 2 inblåsningar)
- Vuxna om den som gör HLR inte vet hur muninblåsningar görs: endast kompressioner
- Spädbarn och barn om en person gör HLR: 30:2
- Spädbarn och barn om två personer gör HLR: 15:2
Bröstkompressioner är den enskilt viktigaste åtgärden för att återuppliva en person med ett hjärtstopp (såvida det inte går att defibrillera omedelbart). Kompressionerna kan generera en perfusion som motsvarar 20% av normal cirkulation (förutsatt att klaffarna fungerar normalt). Det är inte kompression av vänster kamrarna eller förmaken som driver blodflödet. Med effektiva kompressioner skapas tryckvariationer i thorax och dessa tryckvariationer driver blodflödet. Efter en kompression släpps bröstkorgen upp varvid thorax expanderar. Expansionen leder till tryckfall i höger förmak och aorta. Det gör att blod flödar mot dessa rum. Vid kompressionen stiger intrathorakalt tryck samtidigt som hjärtat trycks mot ryggen. Det leder till tryckstegring i höger förmak och aorta, vilket skjuter blodet framåt. Blod kan då perfundera kranskärl, hjärnan och övriga organ. Detta förutsätter att hjärtats klaffar fungerar normalt och att trycket i systemcirkulationen är lägre än det intrathorakala trycket under kompressionen. Perfusionstrycket i kranskärlen (CPP, coronary perfusion pressure) är fundamentalt för att hjärtat ska komma igång. CPP beräknas som tryckskillnaden mellan höger förmak och aorta. Ett perfusionstryck på 15 mmHg anses vara minimum för att väcka elektrisk och mekanisk aktivitet i hjärtat (Ewy et al).
Vid ventilation minskar det koronara perfusionstrycket, vilket gör att flödet i kranskärlen blir sämre. Detta förklaras av att flödet i kranskärlen minskar när intrathorakalt tryck ökar. I flera studier har man undersökt effekten av att ventilera och komprimera samtidigt och det förefaller ge ett sämre kranskärlsflöde men ett bättre extrathorakal (dvs cerebral) perfusion.
HLR med enbart kompressioner (eng. hands-only CPR, compression-only CPR) är kanske likvärdig standard HLR (Jerkemean et al, Riva et al) vid hjärtstopp utanför sjukhus. Därför kan detta rekommenderas oerfarna livräddare som inte kan eller vill göra muninblåsningar.

Gör minimalt med avbrott i bröstkompressioner. Gör endast avbrott för rytmkontroll och defibrillering. Ladda defibrillator i väntan på kompressionspaus; detta sparar livsviktiga sekunder om det visar sig att rytmen är defibrillerbar.
Mekaniska kompressioner (mCPR, mechanical CPR)
Mekanisk HLR görs med apparatur som utför kompressioner med batterikraft (med eller utan tryckluft). Exempel på sådan utrustning är LUCAS, AutoPulse, Lifeline ARM och CorPuls. Ingen av dessa är överlägsen manuell HLR avseende överlevnad. De används ofta vid hjärtstopp eftersom de frigör personal och underlättar HLR under transport i ambulans.



Mekaniska bröstkompressioner rekommenderas när kvalitativa bröstkompressioner inte kan göras (t ex under ambulanstransport eller PCI). En lång rad randomiserade och observationella studier har undersökt om mekanisk HLR påverkar överlevnaden vid hjärtstopp. Bland dessa studier återfinns exempelvis följande:
- Användning av AutoPulse medförde en tre gånger högre överlevnad vid hjärtstopp utanför sjukhus (18.8% vs. 6.3%, p = 0.03), men ingen skillnad i neurologisk funktion bland överlevare och eventuellt orsakar AutoPulse fler organskador (Koster et al, Gao et al).
- LUCAS ger ingen påverkan på överlevnad (Rubertsson et al).
- Det har gjorts 6 systematiska reviews och meta-analyser på mekanisk HLR och det finns inget som talar för att mekaniska kompressioner påverkar överlevnaden (Liu et al, Gates et al), även om en studie indikerade ökad överlevnad med användning av mekaniska kompressioner vid hjärtstopp på sjukhus (Couper et al).
- Det förefaller som att LUCAS är mer effektiv än AutoPulse (Khan et al).
Luftväg och ventilation
En luftväg ska etableras snarast möjligt. Ju mer erfaren personalen är, desto mer avancerad luftväg ska etableras. Endotrakeal intubation görs av erfaren personal och intubationen skall helst inte pausa kompressioner mer än 5 sekunder.
- Ventilera med 10 andetag/min.
- Använd 100% syrgas (O2).
- Varje andetag ska ges över 1 sekund.
- Kontrollera att bröstkorgen höjs och sänks vid ventilationerna.
- Bekräfta tubens position med kapnografi om möjligt.
- Bröstkompressioner fortsätter oavbrutet under ventilationen.



Defibrillering
| Term | Betydelse | Användning av synkronisering |
|---|---|---|
| Defibrillering | Leverans av strömstöt för att avbryta ett ventrikelflimmer | Nej |
| Elkonvertering | Leverans av strömstöt för att avbryta övriga takyarytmier | Ja |
Defibrilleringsplattor placeras så att så mycket myokardium som möjligt hamnar mellan plattorna. Detta innebär som regel att en platta placeras till höger om sternum nedanför höger klavikel och andra elektroden på vänster flank motsvarande platsen för elektroden i EKG-avledning V6.
Moderna defibrillatorer använder bifasisk strömstöt för att leverera en strömstöt till hjärtat. Defibrillatorn justerar strömmens amplitud och duration till impedansen i thorax. Det är avgörande att leverera en tillräckligt stark strömstöt så att arytmin kan termineras. Det finns i dagsläget ingen evidens för att någon energinivå är optimal och den rekommenderade energinivån varierar beroende på tillverkare. Tillverkarens rekommenderade energinivå för defibrillering framgår oftast på maskinen. Det finns tre olika metoder för att leverera bifasisk ström men dessa har aldrig jämförts avseende förmågan att terminera kammararytmier och sannolikt är de lika effektiva (Soar et al).
För att minimera no-flow-tid kan defibrillatorn laddas mot slutet av varje kompressionscykel så att den är redo att avfyras omedelbart vid rytmkontroll. Om rytmkontrollen inte visar en defibrillerbar rytm återupptas kompressionerna omedelbart.
Vissa defibrillatorer kan filtera bort rörelseartefakter och därmed visa den egentliga EKG-signalen under pågående kompressioner. I övriga fall är det oftast omöjligt att se den egentliga EKG-signalen när kompressioner görs.


Risken med höga energinivåer är skador på myokard och andra vävnader. Upp till 360 Joule (J) finns sannolikt ingen risk för myokardskada. Detta har undersökts genom att analysera troponiner, EKG-förändringar och vänsterkammarfunktion efter elkonvertering med 360 J. Högre energinivåer än 360 J skall normalt inte levereras. Lägre energinivåer än 150 J skall inte levereras vid ett hjärtstopp.
Vid ett hjärtstopp ges en strömstöt åt gången. Efter defibrilleringen återupptas kompressioner omedelbart. Det görs ingen rytmkontroll eller pulskontroll efter defibrillering. Kontrollerna görs i nästa paus. Det finns undantag från denna regeln, nämligen bevittnade hjärtstopp med defibrillerbar rytm (patient som är EKG-monitorerad) och en defibrillator finns omedelbart tillgänglig; i dessa fall får man ge upp till tre defibrilleringar (med puls och rytmkontroll emellan) innan man startar vanlig HLR med kompressioner. Förklaringen till detta är att kompressionerna sannolikt inte hjälper så tidigt i förloppet, men då är defibrillering oerhört effektivt. Om arytmin inte är terminerad efter tredje försöket startas HLR enligt algoritmen.
Eskalering av energinivån
Om en defibrillering inte terminerar arytmin kan nästa strömstöt ges antingen med oförändrad energinivå eller högre energinivå. Det finns inga studier som klargjort om eskalering av energinivån påverkar överlevnaden vid hjärtstopp. Eskalering av energinivån är dock associerat med färre defibrilleringar, vilket talar för att det är fördelaktigt att öka energinivån. Därför rekommenderas att energinivån ökas om en defibrillering misslyckas med att terminera ett ventrikelflimmer eller en ventrikeltakykardi (Soar et al).
Refibrillering och refraktärt VF
I över 50% av fallen recidiverar ventrikelflimmer efter en lyckad defibrillering. När detta inträffar bör energinivån eskaleras. Refraktärt ventrikelflimmer föreligger i 20% av fallen med ventrikelflimmer och det innebär att ventrikelflimret recidiverar efter 3 defibrilleringar (Koster et al). Vid refraktärt ventrikelflimmer skall energinivån maximeras (360 J).
Åtgärder vid refraktärt VF:
- Kontrollera plattornas position. Den apikala plattan skall placeras motsvarande elektroden i EKG-avledning V6.
- Öka energinivån till maximal energi (360 J).
Att använda anteroposterior placering av plattorna saknar vetenskapligt stöd, liksom gör använding av dubbel-sekventiell defibrillering (defibrillering med två defibrillatorer samtidigt).
Patienter med ICD (implantable cardioverter defibrillator)
Personer som drabbats av allvarliga kammararytmier eller löper hög risk för att göra det kan utrustas med en ICD. En ICD inopereras som regel under vänster pectoralmuskel. En ICD defibrillerar med 40 J, vilket gör mycket ont om patienten är vaken. Numera finns även subkutan ICD, vilket innebär att ICD-dosa placeras i främre axillarlinjen nedom pectoralmuskeln och en elektrod tunneleras subkutant in mot sternum och upp längs pectoralmuskeln. En strömstöt på 80 J levereras i denna och det är sannolikt lika effektivt som en transvenös (vanlig) ICD (Knops et al). Genom att anbringa en magnet på ICD-dosan kan defibrilleringarna inaktiveras. Om magnet avlägsnas från ICD-dosan kommer defibrilleringsfunktionen aktiveras igen. Att ge bröstkompressioner samtidigt som en ICD defibrillerar med 40 J är ofarligt. Att ge bröstkompressioner samtidigt som en subkutan ICD defibrillerar med 80 J kan vara obehagligt.
Elkonvertering av ventrikeltakykardi (VT)
Ventrikeltakykardi elkonverteras med 150 J, med eskalering av energinivån vid behov. Strömstöten ska vara synkroniserad.
Om en organiserad rytm (ventrikeltakykardi, samtliga supraventrikulära takyarytmier) föreligger ska strömstöten vara synkroniserad. Det innebär att maskinen levererar strömstöten när R-vågen infaller på EKG-kurvan. Syftet med detta är att undvika att leverera ström då T-vågen infaller, eftersom en strömstöt då kan leda till ventrikelflimmer (VF). Ibland kan inte maskinen identifiera R-vågorna och då är det inte tekniskt möjligt att leverera strömstöt i synkroniserat läge. Då bör man överväga att flytta EKG-elektroderna, öka amplituden (förstärkningen) på EKG-signalen eller defibrillera osynkroniserat. Vid osynkroniserad defibrillering ska man vara beredd på att defibrillera omedelbart igen om ett ventrikelflimmer uppkommer.

Defibrillering utgör inget risk för foster.
ROSC efter defibrillering
Om en defibrillering lyckas terminera en kammararytmi och etablera sinusrytm tar det oftast ett par sekunder innan kammarkontraktioner återkommer. Därför saknas som regel palpabel puls de första sekunderna efter sinusrytm återupprättats (Sunde et al, Rea et al). Myokardiet drabbas av stunning (myocardial stunning) vid ett hjärtstopp och detta cellulära tillstånd kan inte normaliseras ögonblickligen efter en lyckad defibrillering. Det kan ta upp till 2 minuter innan kammarkontraktiliteten är normaliserad (Pierce et al).
Sammanfattning av defibrillering
- Bröstkompressioner fortsätter alltid i väntan på att defibrillator anbringas. Använd anterolateral placering av plattorna (se ovan).
- Defibrillera med bifasisk ström med den energinivå som tillverkaren rekommenderar för VF. Den lägsta nivån för VF är 150 J. Högsta säkra energinivån är 360 J och den skall användas om livräddaren är osäker på vilken energinivå som skall användas.
- Om följande tre villkor är uppfyllda kan upp till 3 defibrilleringar utan kompressioner testas: (1) bevittnat hjärtstopp på patient med EKG-övervakning, (2) rytmen är VF/VT och (3) defibrillator är kopplad eller omedelbart tillgänglig. Om det tredje försöket inte resulterar i normalisering av rytm skall HLR med bröstkompressioner startas.
- Överväg att ladda defibrillatorn mot slutet av kompressionscykeln för att den skall vara redo att defibrillera omedelbart om rytmen är defibrillerbar. Om defibrillatorn inte är laddad skall kompressioner fortsätta tills den är redo att avfyra.
- Efter en defibrillering fortsätter kompressioner omedelbart (i 2 minuter). Rytmkontroll och pulskontroll görs i nästa kontrollperiod.
- Defibrillering kan göras under pågående mekaniska kompressioner.
Takyarytmi med hot om hjärtstopp
Om patienten är vaken men cirkulatoriskt instabil och det föreligger hot om hjärtstopp skall elkonvertering omedelbart göras. Vakna patienter sederas eller sövs innan elkonvertering. Detta gäller oavsett om takyarytmin är ventrikulär eller supraventrikulär. Förmaksflimmer elkonverteras med maximal energinivå (360 J) om patienten är instabil (även om 200 J oftast räcker). Övriga förmaksarytmier (förmaksfladder, förmakstakykardi, m fl) elkonverteras som regel med 70-120 J. Om elkonvertering misslyckas och patienten är stabil kan nytt försök göras och 300 mg amiodarone kan ges intravenöst under 10-20 minuter, vilket ökar sannolikheten för att elkonvertering ska lyckas. Procainamid (10-15 mg/kg över 20 minuter) är ett alterantivt som inte finns att tillgå i Sverige. Om en kammararytmi föreligger utan hot om hjärtstopp kan farmakologisk behandling provas först. Förmaksflimmer kan även frekvensregleras med beta-blockerare och digoxin. Erinra att amiodarone kan ges även vid uttalad nedsättning av vänsterkammarfunktion.
Pacing vid hjärtstopp
Defibrillatorer är utrustade med pacemakerfunktion (se bild ovan). Med denna funktion kan transkutan pacing göras, vilket kan vara livräddande vid bradykardier. Pacemaker är verkningslös vid asystoli. Pacemaker bör dock provas om det föreligger P-vågor på EKG-kurvan. Detta talar för ett höggradigt (totalt) AV-block utan ersättningsrytm. Om det finns anledning att tro att pacing skulle kunna ge kammarkontraktioner kan det provas.
Bradyarytmi med hot om hjärtstopp
- Börja med atropin 0.5 mg iv eller io. Atropin kan upprepas var 3:e minut upp till 6 doser.
- Om atropin är otillräckligt ges isoprenaline 5 mg/min i startdos och titreras upp till önskad kammarfrekvens.
- Om isoprenaline är otillräckligt ges adrenalin 2-10 mg/min iv.
- Om bradykardi orsakas av inferior hjärtinfarkt, eller om patienten är hjärttransplanterad eller har en ryggmärgsskada provas aminofyllin 100-200 mg iv långsamt. Atropin är kontraindicerat vid hjärttransplantation då det kan orsaka höggradigt AV-block och sinusarrest.
- Om bradykardi orsakats av kalciumflödeshämmare eller beta-blockerare kan glukoagon ges.
- Om ovanstående inte är tillräckligt, eller inte kan ges tillräckligt fort, startas transkutan pacemaker med hjälp av defibrillator. Transkutan pacemaker används tills en transvenös pacemaker kan etableras.
Tecken på ROSC
Om patienten rör sig, får blodtryck, kraftig stegring i ETCO2 eller börjar vakna kan HLR pausas för puls- och rytmkontroll.
ECMO (eCPR, extracorporeal CPR)
ECMO står för extracorporeal membrane oxygenation, vilket innebär att blodet syresätts och cirkuleras med hjälp av en hjärt-lungmaskin. ECMO innebär omedelbar etablering av veno-arteriell ECMO (VA-ECMO). VA-ECMO används när stabil ROSC inte kan etableras hos en individ som kan överleva med god livskvalitet om cirkulationen stöttas temporärt med ECMO. ECMO kan behövas för att genomföra PCI eller lungemboliektomi. ECMO ska vara en brygga till definitiv eller förmodad lösning.
I Sverige används ECMO på fåtal sjukhus. Det finns inga nationellt eller internationellt fastställda kriterier för användning av ECMO. De vanligaste kriterierna för ECMO är som följer:
- Bevittnat hjärtstopp med omedelbar bystander HLR.
- ECMO ska etableras inom 60 minuter från att HLR startade.
- Patienten ska vara ung (<65 år) och inte ha tung komorbiditet.
- Orsaken till hjärtstoppet ska vara reversibel.
- Indikationen är starkare för unga patienter.
Läkemedel
Skapa access
Försök etablera intravenös (iv) access. Om intravenös access inte kan etableras bör intraosseös (io) access skapas.
Adrenalin (Epinefrin)
- Adrenalin 1 mg iv eller io ges omedelbart om första rytm inte är defibrillerbar.
- Adrenalin 1 mg iv eller io ges efter tredje defibrilleringen vid defibrillerbar rytm.
- Adrenalin 1 mg iv eller io ges var fjärde minut under HLR.
Adrenalin är en vasopressor med inotrop och kronotrop effekt. Adrenaline kan åstadkomma följande under ett hjärtstopp:
- Adrenalin ökar koronart perfusionstryck (CPP).
- Adrenalin kan inducera elektrisk aktivitet i myokardiet.
- Adrenalin kan konvertera ett finvågigt ventrikelflimmer (som inte går att defibrillera) till ett grovvågigt ventrikelflimmer (som går att defibrillera).
- Adrenalin ökar hjärtfrekvensen vid bradykardi.
- Adrenalin kan förbättra elektrisk stabilitet.
- Adrenalin kan konvertera PEA till mekanisk koppling.
- Adrenalin ökar kontraktilitet (inotropi).
- Adrenalin höjer blodtrycket.
- Adrenalin ökar sannolikheten för att en defibrillering skall lyckas
- Högre doser adrenalin (5 mg istället för 1 mg) ger mer ROSC men oförändrad överlevnad. Eftersom den högre dosen adrenalin ger sämre myokardfunktion under intensivvården avrådes den.
På intensivvårdsavdelning kan adrenalin ersättas med dopamin eller dobutamin om inotrop effekt önskas utan kronotrop effekt.
I den största randomiserade kontrollerade studien på adrenalin vid hjärtstopp utanför sjukhus (PARAMEDIC 2) drogs följande slutsatser (Perkins et al):
- Adrenalin medförde 39% högre sannolikhet för överlevnad vid 30 dagar (skillnaden var statistiskt signifikant och detta var studiens primära utfallsmått).
- Adrenalin medförde 18% högre sannolikhet för att skrivas ut vid liv men denna skillnad var inte statistiskt signifikant.
- I gruppen som fick adrenalin var det fler som hade neurologiska skador vid utskrivning.
Sammantaget talar detta för att adrenalin ökar överlevnaden vid 30 dagar på bekostnad av att en större andel får neurologiska skador. Förklaringen till att fler drabbas av hjärnskador med adrenalin kanske är adrenalines negativa inverkan på cerebralt mikrovaskulärt blodflöde (Ristagno et al, Deakin et al).
Antiarytmika
Antiarytmika ges om en kammararytmi (VF, VT) inte kan termineras med defibrillering.
- Amiodarone 300 mg iv eller io ges till vuxna med VF/VT efter tredje defibrilleringen.
- Amiodarone 150 mg iv eller io ges till vuxna med VF/VT efter femte defibrilleringen.
- Lidokain 100 mg iv eller io ges om amiodarone inte finns eller om arytmin är av typen torsade de pointes (TdP). Ytterligare 50 mg lidokain kan ges efter femte defibrilleringen.
- Vid akut (transmural) hjärtinfarkt är lidokain sannolikt mer effektivt än amiodarone.
- Vid ROSC kan amiodarone ges som kontinuerlig infusion (total dygnsdos 1200 mg).
I en jämförelse mellan amiodarone, lidokain och placebo är överlevnad vid utskrivning likvärdig, men placebo medför att en lägre andel läggs in vid liv efter hjärtstopp utanför sjukhus. Både amiodarone och lidokain medför högre överlevnad om bystander-HLR hade givits. Eventuellt saknar dessa antiarytmika effekt vid intraosseös administrering (Kudenchuk et al, Daya et al).

Amiodarone utgör ingen risk för foster.
Beta-blockerare
Beta-blockerare (metoprolol, esmolol) och magnesium bör övervägas vid:
- Polymorf VT som inte svarar på amiodarone.
- Torsade de pointes (TdP)
- Monomorf snabb VT eller ventrikelfladder.
- Refraktär VF eller VT.
Magnesium (magnesiumsulfat)
- Magnesiumsulfat 2 g iv ges alltid vid torsade de pointes (oavsett magnesiumnivån i blodet). Injektionen kan upprepas och användas som infusion.
Kalciumglukonat
- Vid hyperkalemi, hypokalcemi eller överdos av kalciumblockare kan injektion 10 % kalciumglukonat vara livräddande.
Natriumbikarbonat
- Natriumbikarbonat kan ges vid hyperkalemi och läkemedelsöverdos.
Vätska
- Flusha in vätska om hjärtstoppet kan orskas av hypovolemi.
Trombolys
- Om lungemboli är orsaken till hjärstoppet skall trombolys ges.
- Preparat: Alteplas (Actilyse ®).
- Dosering: Actilyse är förpackat i ampuller. Ampull I och II blandas enligt instruktioner i förpackningen till styrkan 1 mg/ml. Denna lösning dras upp direkt i infusionsspruta 50 ml. Ge en bolus 0,6 mg/kg (max 50 mg) iv och därefter infusion 50 mg på 90 min (sammanlagda dos max 1.5 mg/kg om kroppsvikt <65 kg).
Kapnografi (sluttidala koldioxidnivåer, ETCO2)
Kapnografi innebär mätning av sluttidala koldioxnivåer (ETCO2) i lungorna. ETCO2 är partialtrycket för koldioxid (PCO2) i slutet av expirationen. ETCO2 mäter summan av ventilationen, metabolismen och perfusionen i kroppen. Detta förklaras av att koldioxid (CO2) bildas som en restprodukt av aerob metabolism och transporteras från vävnaden tillbaka till lungorna där det expireras. Det slutliga partialtrycket CO2 i utandningsluften är således en summa av metabolism, pefusion och ventilation. ETCO2 kan mätas kontinuerlig med sensorer som finns på intubations- och ventilationsutrustning.
Normalt kapnogram

- Fas I (inspiratorisk baslinje) reflekterar inandad luft, vilken saknar CO2.
- Fas II (snabb exspiration) reflekterar transport av luft från anatomiskt dött rum till ventilerat rum.
- Fas III är en alveolär platå. ETCO2 är PCO2 som registreras precis innan inspirationen börjar. Detta är en adekvat surrogatmarkörer för alveolärt PCO2.
- Fas 0 är inspirationen på nästa andetag.
Normalvärde ETCO2: 38 mmHg (5 kPa) eller 5%.
Med ETCO2 kan man monitorera:
- Effekten av ventilationen.
- Ventilationshastighet.
- Treakealtubens position kan bekräftas.
- Kompressionernas effektivitet kan mätas.
- Återkomst av ROSC kan upptäckas.
- Prognosen kan bedömas.
Orsaker till en platt ETCO2-kurva
- Ventilator avstängd eller kapnograf inte påkopplad
- Felplacerad tub
- Hjärtstopp utan perfusion (av kompressioner).
ETCO2 skall helst mätas i trakealtub men det går att mäta med supraglottisk luftväg och Rubens blåsa. Vid ROSC kan ETCO2 öka 3 gånger från nivån under kompressioner. Plötslig stegring i ETCO2 talar för ROSC eller korrigerat tubläge. Stegring i ETCO2 kommer innan den palpabla pulsen vid ROSC.
Om ETCO2 inte överstiger 1.33 kPa (10 mmHg) under HLR är prognosen mycket dålig. Detta är gränsvärdet för att starta ECMO (Soar et al). ETCO2 stiger gradvis under HLR på de som får ROSC och vice versa. Eftersom många faktorer påverkar ETCO2 (tidpunkt för mätning, orsak till hjärtstopp, kompressionskvalitet, ventilationsdjup och frekvens, adrenalin, etc) är det rekommenderat att prognosen görs baserat på trenden i ETCO2, snarare än enstaka punktmätningar. ETCO2 ska ej användas som isolerat beslutsstöd för att avsluta HLR eller initiera ECMO (Paiva et al).
Om ETCO2 och andra parametrar talar för ROSC kan kompressioner pausas.
Ultraljud (ekokardiografi)
Riktad ekokardiografi (POCUS, point of care ultrasound) vid hjärtstopp innebär att en van undersökare gör en mycket snabb kontroll av kammarkontraktioner och perikardstatus. Finare undersökning kan göras vid behov. Undersökningen får ta lika många sekunder som rytm och pulskontroll. Under pågående kompressioner är det mycket svårt att få bra bildfönster men det är ibland möjligt subkostalt, särskilt under korta ögonblick.
- En vidgad högerkammare talar för lungemboli, men specificiteten är låg. Specificiteten är högre om septum buktar in i vänster kammare.
- Tamponad kan diagnoseras enkelt med ultraljud. Akut tamponad beror som regel på aortadissektion och bland dessa patienter är överlevare sällsynta.
Bedömning av pupiller (pupillreflex) vid hjärtstopp
Pupiller som är små och reagerar på ljus är prognostiskt gynnsamt vid hjärtstopp. Vidgade och ljusstela pupiller talar för hjärndöd och är således en negativ prognostisk faktor. Det är otvetydigt att vidgade och ljusstela pupiller (dvs avsaknad av pupillreflex) 48 timmar efter hjärtstopp talar mycket starkt för hjärndöd. Men avsaknad av pupillreflex i akutskedet är svårare att bedöma. Flera läkemedel kan orsaka vidgade och ljusstela pupiller, inklusive adrenalin som ges till merparten av patienter som drabbas av hjärtstopp. I en stor fransk studie (Javaudin et al) med över elva tusen hjärtstopp studerades sambandet mellan pupillreflex vid ankomst till akutmottagningen och neurologisk status vid 30 dagar. Resultaten var som följer:
- Frånvaro av pupillreflex hade sensitivitet på 72.2% för dålig neurologisk outcome. Det betyder att denna undersökningen missade 27.8% av alla med dålig neurologisk outcome.
- Frånvaro av pupillreflex hade specificitet på 68.8% för dålig neurologisk outcome. Det innebär att nästan var tredje som hade god neurologisk outcome hade patologisk pupillreflex.
- Bland patienter som skrevs ut med god neurologisk funktion saknade 31.2% pupillreflex vid ankomst.
- Frånvaro av pupillreflex innebär 3 gånger ökad risk för dålig outcome.
- Sammantaget är avsaknad av pupillreflex vid ankomst till sjukhus en negativ prognostisk markör men inte tillräckligt stark för att användas isolerat för att fatta beslut om att avsluta HLR.
Referenser
Berdowski J, Beekhuis F, Zwinderman AH, Tijssen JG, Koster RW. Importance of the first link: description and recognition of an out-of-hospital cardiac arrest in an emergency call. Circulation 2009;119:2096-2102.
Hasselqvist-Ax I, Riva G, Herlitz J, et al. Early cardiopulmonary resuscitation in out-of-hospital cardiac arrest. N Engl J Med 2015;372:2307-2315.
Kitamura T, Kiyohara K, Sakai T, et al. Public-access defibrillation and out-of-hospital cardiac arrest in Japan. N Engl J Med 2016;375:1649-1659.
Ewy G.A. Cardiocerebral and cardiopulmonary resuscitation – 2017 update. Acute Med Surg. 2017;4:227–234. 29123868
Pollack R.A, Brown S.P, Rea T, et al. Impact of bystander automated external defibrillator use on survival and functional outcomes in shockable observed public cardiac arrests. Circulation. 2018;137:2104–2113. 29483086
Koster RW, Beenen LF, van der Boom EB, et al. Safety of mechanical chest compression devices AutoPulse and LUCAS in cardiac arrest: a randomized clinical trial for non-inferiority. Eur Heart J 2017;38:300613. 347.
Gao C, Chen Y, Peng H, Chen Y, Zhuang Y, Zhou S. Clinical evaluation of the AutoPulse automated chest compression device for out-of-hospital cardiac arrest in the northern district of Shanghai. China. Arch Med Sci 2016;12:56370.
Rubertsson, MD, PhD1; Erik Lindgren, MD1; David Smekal, MD, PhD1; Ollie Östlund, PhD2; Johan Silfverstolpe, MD3; Robert A. Lichtveld, MD, PhD4; Rene Boomars, MPA4; Björn Ahlstedt, MD5; Gunnar Skoog, MD6; Robert Kastberg, MD6; David Halliwell, RN7; Martyn Box, RN7; Johan Herlitz, MD, PhD8; Rolf Karlsten, MD, PhD.Mechanical Chest Compressions and Simultaneous Defibrillation vs Conventional Cardiopulmonary Resuscitation in Out-of-Hospital Cardiac Arrest The LINC Randomized Trial. JAMA. 2014;311(1):53-61.
Perkins Gavin, M.D., Chen Ji, Ph.D., Charles D. Deakin, M.D., Tom Quinn, M.Phil., Jerry P. Nolan, M.B., Ch.B., Charlotte Scomparin, M.Sc., Scott Regan, B.A., John Long, Anne Slowther, Ph.D., Helen Pocock, M.Sc., John J.M. Black, M.B., B.S., Fionna Moore, M.B., B.S., Rachael T. Fothergill, Ph.D., Nigel Rees, M.Sc., Lyndsey O’Shea, B.Sc., Mark Docherty, M.Sc., Imogen Gunson, M.Sc., Kyee Han, M.B., B.S., Karl Charlton, B.Sc., Judith Finn, Ph.D., Stavros Petrou, Ph.D., Nigel Stallard, Ph.D., Simon Gates, Ph.D., and Ranjit Lall, Ph.D. for the PARAMEDIC2 Collaborators. Randomized Trial of Epinephrine in Out-of-Hospital Cardiac Arrest List of authors. N Engl J Med 2018; 379:711-721
Liu M, Shuai Z, Ai J, et al. Mechanical chest compression with LUCAS device does not improve clinical outcome in out-of-hospital cardiac arrest patients: A systematic review and meta-analysis. Medicine (Baltimore) 2019;98:e17550.
Gates S, Quinn T, Deakin CD, Blair L, Couper K, Perkins GD. Mechanical chest compression for out of hospital cardiac arrest: Systematic review and meta-analysis. Resuscitation 2015;94: 917.)
Couper K, Yeung J, Nicholson T, Quinn T, Lall R, Perkins GD. Mechanical chest compression devices at in-hospital cardiac arrest: A systematic review and meta-analysis. Resuscitation 2016;103:24
Khan SU, Lone AN, Talluri S, Khan MZ, Khan MZU, Kaluski E. Efficacy and safety of mechanical versus manual compression in cardiac arrest – A Bayesian network meta-analysis. Resuscitation 2018;130:1828.
Koster RW, Walker RG, Chapman FW. Recurrent ventricular fibrillation during advanced life support care of patients with prehospital cardiac arrest. Resuscitation 2008;78:2527.
Knops et al. Subcutaneous or Transvenous Defibrillator Therapy. N Engl J Med 2020; 383:526-536
Sunde K, Eftestol T, Askenberg C, Steen PA. Quality assessment of defibrillation and advanced life support using data from the medical control module of the defibrillator. Resuscitation 1999;41:23747.
Rea TD, Shah S, Kudenchuk PJ, Copass MK, Cobb LA. Automated external defibrillators: to what extent does the algorithm delay CPR? Ann Emerg Med 2005;46:13241.
Pierce AE, Roppolo LP, Owens PC, Pepe PE, Idris AH. The need to resume chest compressions immediately after defibrillation attempts: an analysis of post-shock rhythms and duration of pulselessness following out-of-hospital cardiac arrest. Resuscitation 2015;89:1628.
Kudenchuk P.J, Brown S.P, Daya M, et al. Amiodarone, lidocaine, or placebo in out-of-hospital cardiac arrest. N Engl J Med . 2016;374:1711–1722. 27043165
Daya M.R, Leroux B.G, Dorian P, et al. Survival after intravenous versus intraosseous amiodarone, lidocaine, or placebo in out-of-hospital shock-refractory cardiac arrest. Circulation . 2020;141:188–198. 31941354
Ristagno G, Tang W, Huang L, et al. Epinephrine reduces cerebral perfusion during cardiopulmonary resuscitation. Crit Care Med 2009;37:1408-1415.
Deakin CD, Yang J, Nguyen R, et al. Effects of epinephrine on cerebral oxygenation during cardiopulmonary resuscitation: a prospective cohort study. Resuscitation 2016;109:138-144.
Paiva EF, Paxton JH, O’Neil BJ. The use of end-tidal carbon dioxide (ETCO2) measurement to guide management of cardiac arrest: A systematic review. Resuscitation 2018;123:17.
Javaudin 1, B Leclere 2, J Segard 3, Q Le Bastard 4, P Pes 5, Y Penverne 5, P Le Conte 5, J Jenvrin 5, H Hubert 6, J Escutnaire 6, E Batard 4, E Montassier. Prognostic performance of early absence of pupillary light reaction after recovery of out of hospital cardiac arrest. Resuscitation . 2018 Jun;127:8-13.

