Hjärtstoppets elektriska, cirkulatoriska och metabola fas
Förloppet från hjärtstopp till död följer en patofysiologisk process som påverkar behandlingarnas effektivitet. För att maximera sannolikheten för att återupprätta cirkulationen bör interventionerna anpassas till den aktuella fasen. Nuvarande riktlinjer beaktar dock inte detta faktum (utöver rekommendationen att defibrillera omedelbart om hjärtstoppet är bevittnat och triggat av ett ventrikelflimmer eller ventrikeltakykardi). Förklaringen till detta är att det inte existerar en metod för att klargöra vilken fas som föreligger. Faserna under ett hjärtstopp beskrevs av Weisfeldt och Becker (2002). Med utgångspunkt i fysiologi, observationella och experimentella studier beskrev de tre faser, vilka kräver olika behandlingsstrategier för att maximera överlevnaden. Faserna är som följer:
| Fas | Duration | Optimal behandling |
|---|---|---|
| Elektriska fasen | 0 till 4 minuter | Defibrillering |
| Cirkulatoriska fasen | 4 till 10 minuter | Kompressioner och ventilation, följt av defibrillering |
| Metabola fasen | 10 minuter och senare | Kompressioner och ventilation, metabol korrigering, följt av defibrillering |
En lång rad observationella och experimentella studier (djurstudier och humanstudier) stödjer dessa tre faser. Den elektriska och cirkulatoriska fasen förklaras av cellulära förändringar i myokardiet. Den sista fasen är multifaktoriell och förklaras av cellulära förändringar, acidos, inflammation, etc.
Myokardiellt syrebehov
Myokardium är mycket energikrävande vävnad. Dygnsbehovet ATP (cellernas energisubstrat) är cirka 6 kg i humant hjärta (Neubauer et al). Hjärtat har låg kapacitet att lagra ATP, vilket beror på att cellvolymen upptas av den kontraktila apparaten (aktin, myosin). Istället uppvisar myokardiet en oerhörd produktionsförmåga, så till vida att hela ATP-arsenalen kan reproduceras på 10 sekunder (Fell et al, Houtkooper et al). ATP används huvudsakligen till kontraktion (70%) och upprätthållande av jonkanalfunktion (30%).
Neumar et al studerade hur ATP-koncentrationen sjunker vid ett hjärtstillestånd orsakat av ventrikelflimmer (VF). Detta gjordes genom att ta biopsier i myokardiet under sinusrytm och därefter vid bestämda tidsintervaller för att mäta ATP-koncentrationen under hjärtstillestånd. Resultaten framgår av Figur 1.
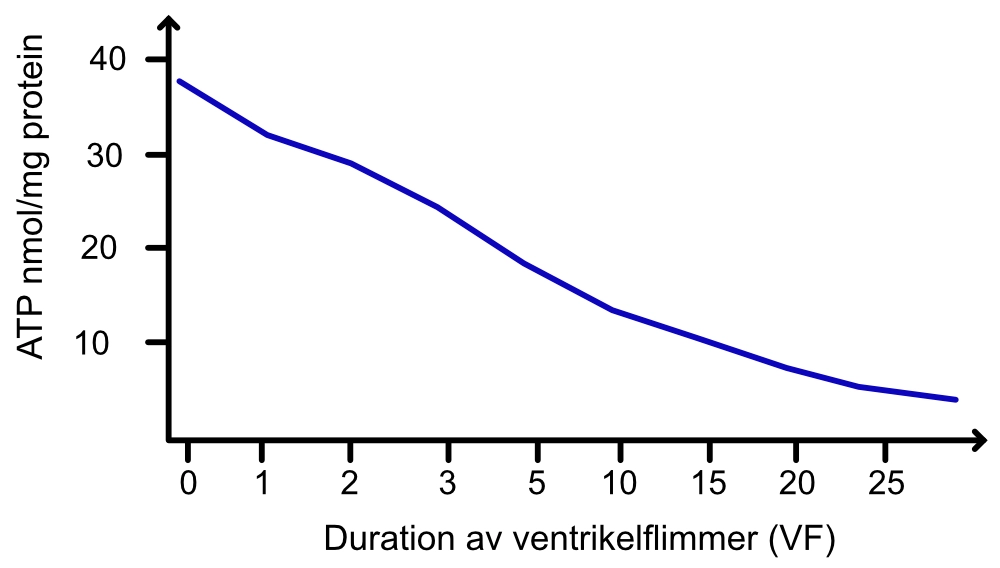
Allteftersom ATP-koncentrationen sjunker upphör cellfunktioner, särskilt jonkanalfunktioner som är kritisk för myokardcellen. I studien konstaterade man att efter cirka 5 minuter hjärtstopp återstår ungefär 50% av ATP-mängden, och efter 15 minuter återstår cirka 20%. Kontraktil dysfunktion uppstår efter 5 minuter hjärtstopp och efter 30 minuter inträder myokardnekros.
Den elektriska fasen
Sannolikt triggas majoriteten av alla hjärtstopp av ventrikeltakykardi (VT) eller ventrikelflimmer (VF). I det hyperakuta skedet (de första minuterna) är defibrillering oerhört effektivt. Detta är tydligt i kliniska studier där man studerat effekten av ICD (implantable cardioverter defibrillator). En ICD är programmerad att upptäcka VF/VT och defibrillera inom 10–20 sekunder. Studier visar att ICD lyckas avbryta hjärtstopp i 98% av alla fall med VF/VT (Zipes et al, Volosin et al). För individer som befinner sig på sjukhus när ett hjärtstopp inträffar kan VF/VT upptäckas och defibrilleras tidigt. Av de hjärtstopp som defibrilleras inom 3 minuter överlever 70% (Hessulf et al). Vid hjärtstopp utanför sjukhus är fördröjningen betydligt längre; mediantiden till ambulansens ankomst är 11 minuter i Sverige, vilket resulterar i en överlevnad på 33% när rytmen går att defibrillera (Rawshani et al).
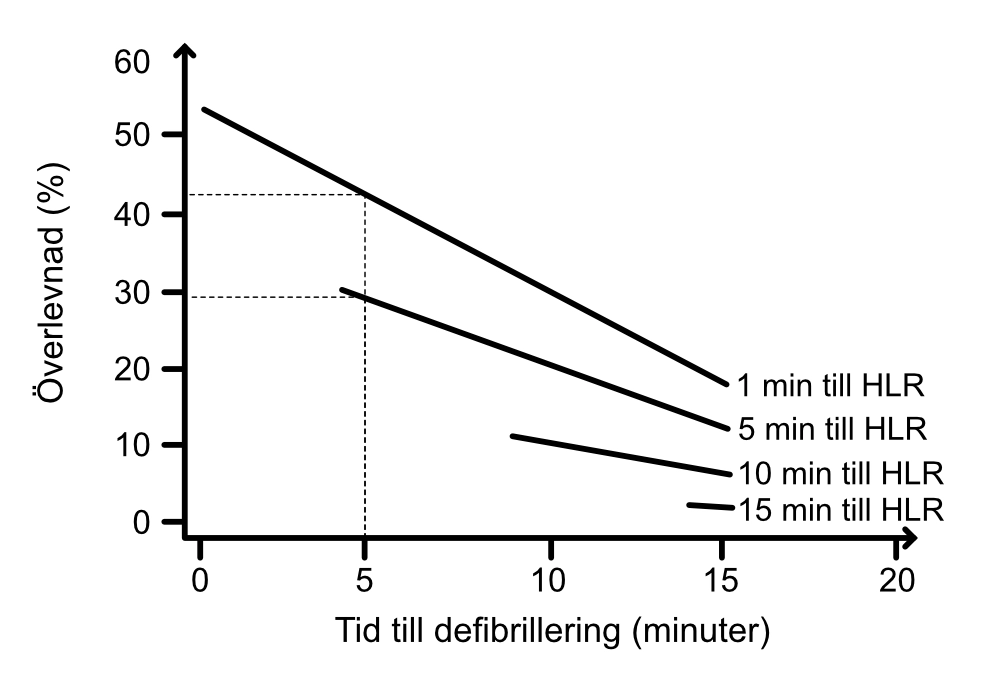
För varje minut som förlöper (med cirkulatoriskt stillestånd) minskar sannolikheten för att VF går att defibrillera och risken för att VF skall övergå i asystoli ökar. Figur 2 visar hur överlevnaden sjunker från 42% till 29% vid försök att defibrillera efter 5 minuter om HLR startas vid 1 respektive 5 minuter (hjärtstopp utanför sjukhus med VF; Valenzula et al).
I den tidiga fasen (<5 minuter) finns sannolikt ingen, eller endast en liten, vinst av kompressioner när rytmen är defibrillerbar (Niemann et al).
Den cirkulatoriska fasen
År 1943 demonstrerade Gurvich et al att sannolikheten för att lyckas defibrillera ett VF som förelegat flera minuter ökade om defibrilleringen föregicks av kompressioner. Som framgår av Figur 2 är defibrillering mindre effektiv när tid till kompressioner ökar. Den cirkulatoriska fasen startar ungefär efter 4 minuter och under denna fasen är effekten av defibrillering sämre. Kompressioner (cirkulationen) är kritisk för att perfundera myokardiet, så att det blir mottagligt för defibrilleringen. Sannolikheten för att lyckas defibrillera VF ökar om kompressioner föregår defibrillering under denna fasen. Detta har demonstrerats i flera djurstudier:
- Yakaitis et al visade att defibrillering var optimal första behandling om det kunde göras inom 3 minuter från cirkulationsstillestånd. Efter 5 minuter VF lyckades defibrillering i 30% av fallen, jämfört med 70% av fallen när kompressioner föregick defibrillering.
- Niemann et al visade att om VF förelegat i 7 minuter var defibrillering 3 gånger mer effektiv om det föregicks av kompressioner.
- Menegazzi et al visade att om VF förelegat 8 minuter var defibrillering 3 gånger effektivare om det föregicks av kompressioner och antiarytmika.
- Garcia et al visade att defibrillering var ineffektiv om VF förelegat i 6 minuter.
En rad studier visar således att ju längre VF föreligger, desto mindre är sannolikheten för att defibrillering lyckas. Detta kan motverkas genom att utföra kompressioner och ventilation. Kompressionerna är kritiska för att generera det koronara perfusionstryck som krävs för att myokardcellernas elektriska potential skall normaliseras. Faktum är att myokardcellerna efter ett par minuter blir så känsliga för avbrott i perfusionen att tiden det tar för defibrillatorn att ladda ökar mortaliteten. Yu et al demonstrerade detta (djurstudie) genom att avsiktligen fördröja defibrilleringen med 3, 10, 15 eller 20 sekunder (paus efter kompressioner); alla defibrilleringar lyckades om avbrottet var 3 sekunder långt, men inga lyckades om avbrottet var 15 sekunder eller längre. Efter ett avbrott i kompressioner tar det ungefär 15 sekunder (med kompressioner) för att återuppbygga ett adekvat koronart perfusionstryck.
När Cobb et al undersökte effekten av att genomföra 90 sekunder kompressioner innan defibrillering vid hjärtstopp utanför sjukhus (med VF som initial rytm) så noterades en 42% högre sannolikhet för överlevnad i de fall ambulansens responstid var 4 minuter eller längre (dvs under den cirkulatoriska fasen). En norsk studie med 200 hjärtstopp utanför sjukhus visade likaledes att 3 minuter HLR innan defibrillering ökade sannolikheten för ROSC 2.2 gånger när ambulansens responstid var längre än 5 minuter (Wik et al).

EKG avspeglar den patofysiologiska process som gör defibrilleringen ineffektiv efter flera minuter med ventrikelflimmer (Figur 3). Parallellt med att ATP-koncentrationen minskar i myokardiet så minskar också ventrikelflimrets amplitud. EKG visar en övergång från ett grovvågigt till finvågigt ventrikelflimmer. Ju längre ventrikelflimret föreligger, desto mer finvågig blir vågformen, innan den övergår till asystoli (avsakand av elektrisk aktivitet).
Den metabola fasen
Dödsfallen inträffar under den metabola fasen, som börjar ungefär efter 10 minuter. Egentligen inträder biologisk död (hjärndöd) efter 6 minuter totalt cirkulationsstillestånd. Individer som överlever längre durationer hjärtstopp har särskilda förutsättningar som förlänger tiden till biologisk död (exempelvis perioder med ventrikeltakykardi som genererar cardiac output, ung ålder, accidentel nedkylning, etc). Om hjärt-lungräddning startas under den metabola fasen är kompressioner och defibrillering oftast otillräckligt för att rädda individen. I dagsläget är det oklart vilken behandling som är den optimala under denna fasen.
Metabolt karaktäriseras denna fasen av omfattande cerebral celldöd och begynnande myokardnekros. Myokardiets ATP-nivå är så låg att elektrisk aktivitet har upphört (asystoli föreligger). Resterande vävnader har utvecklat ischemi med efterföljande lokal och global acidos. Effektiva kompressioner kan då resultera i reperfusionsskador som förvärrar vävnadsskadorna. Det finns data på att reperfusion i myokardium accelererar myokardnekros (Vanden Hoek et al). Vidare föreligger uttalade elektrolytrubbningar som försvårar möjligheten att bibehålla ROSC.
Under den metabola fasen utvecklas hjärnskador och myokardinfarkt både av ischemin (som orsakar celldöd genom att kritiska cellfunktioner upphör) och toxiska effekter av reperfusion (som induceras av HLR). Reperfusionsskador uppstår när syreleverans till vävnaden resulterar i produktion av reaktiva syreföreningar (reactive oxygen species, ROS). Reperfusionsskador uppstår bara om det dröjer för länge till syreleverans; det finns en okänd tidsgräns då syreleverans leder till vävnadsskada. Mekanismerna bakom detta är komplicerade och diskuteras av Patil et al.
Referenser
Kaustubha D. Patil, Henry R. Halperin, Lance B. Becker. Cardiac Arrest Resuscitation and Reperfusion. Circulation Research (2015).
Neubauer S. The failing heart—An engine out of fuel. New England Journal of Medicine. 2007;356:1140-1151
Fell DA, Sauro HM. Metabolic control analysis. The effects of high enzyme concentrations. European Journal of Biochemistry. 1990;192:183-187
Houtkooper RH, Canto C, Wanders RJ, Auwerx J. The secret life of nad: An old metabolite controlling new metabolic signaling pathways. Endocrine Reviews. 2010;31:194-223
Gurvich NL, Yuniev GS. Restoration of heart rhythm during fibrillation by a condenser discharge. Am Rev Sov Med 1947;4:252–6.
Vanden Hoek TL, Shao Z, Li C, Zak R, Schumacker PT, Becker LB. Reperfusion injury in cardiac myocytes after simulated ischemia. Am J Physiol. 1996;270: H1334-H1341. 30.
Vanden Hoek TL, Qin Y, Wojcik K, et al. Reperfusion, not simulated ischemia, initiates intrinsic apoptosis injury in chick cardiomyocytes. Am J Physiol Heart Circ Physiol.
Yakaitis RW, Ewy GA, Otto CW, Taren DL, Moon TE. Influence of time and therapy on ventricular defibrillation in dogs. Crit Care Med. 1980;8:157-163.
Menegazzi JJ, Davis EA, Yealy DM, et al. An experimental algorithm versus standard advanced cardiac life support in a swine model of out-of-hospital cardiac arrest. Ann Emerg Med. 1993;22:235-239. 23.
Menegazzi JJ, Seaberg DC, Yealy DM, Davis EA, MacLeod BA. Combination pharmacotherapy with delayed countershock vs standard advanced cardiac life support after prolonged ventricular fibrillation. Prehosp Emerg Care. 2000;4:31-37.
Niemann JT, Cairns CB, Sharma J, Lewis RJ. Treatment of prolonged ventricular fibrillation. Circulation. 1992;85:281-287. 20.
Niemann JT, Cruz B, Garner D, Lewis RJ. Immediate countershock versus cardiopulmonary resuscitation before countershock in a 5-minute swine model of ventricular fibrillation arrest. Ann Emerg Med. 2000;36:543-546.
Garcia LA, Allan JJ, Kerber RE. Interactions between CPR and defibrillation waveforms. Resuscitation. 2000;47:301-305.

