Lungemboli



Vid lungemboli är en eller flera lungartärer ockluderade av emboliskt material. I majoriteten av alla fall utgörs ocklusionen av en tromb som bildats i de djupa venerna i benen eller bäckenet. Trombmaterial som bildas i benen eller bäckenet (oftast vena iliaca) kan lossna och föras via vena cava inferior till hjärtat. Tromben pumpas från höger kammare ut genom pulmonalisklaffen till lungartären. Eftersom kärldiametern minskar successivt från pulmonalisklaffen så kommer tromben orsaka en ocklusion vars effekt är avhängig av trombens storlek och form. En stor tromb leder till proximal ocklusion och således större inverkan på lungperfusionen och hemodynamiken.
Ocklusionen har två omedelbara effeker: (1) reducerad genomblödning i lungparenkymet resulterar i hypoxi och (2) reducerad preload i vänster kammare och därmed reducerad cardiac output (hjärtminutvolym). Enstor tromb i lungartären kan leda till omedelbar cirkulatorisk kollaps och hjärtstillestånd.
Lungemboli är starkt korrelerat till djup ventrombos (DVT). Ungefär 70% av alla med symptomatisk lungemboli har en samtidigt DVT, och 30% av alla med DVT asymptomatiska lungembolier (Di Nisio et al). Riskfaktorer för lungemboli överlappar i hög grad med riskfaktorer för DVT. Immobilisering, genomgången kirurgi, koagulationsrubbning med hyperkoagulabilitet och graviditet är exempel på riskfaktorer för DVT och lungemboli.
Eftersom många med lungemboli behöver trombolys så måste man tidigt överväga differentialdiagnoser som kan påverka benägenheten att ge trombolys. Hjärttamponad, aortaaneurysm och aortadissektion är de viktigaste differentialdiagnoserna som påverkar trombolysbehandling.
Epidemiologi
- Venös tromboembolism (VTE) är den tredje vanligaste kardiovaskulära dödsorsaken. Endast stroke och akut hjärtinfarkt är vanligare (Raskob et al).
- De senaste decennierna har incidens av lungemboli ökat. Potentiella förklaringar till detta är ökad förekomst av cancer, hjärtsvikt, åldrande befolkning, ökat stillasittande och ökad förekomst av fetma. Förbättrad diagnostik (ökad användning av datortomografi) kan också utgöra en del av förklaringen.
- Livstidsrisken att drabbas av venös tromboembolism är 8% för en person som är 45 år gammal idag (Raskob et al, Heit et al).
- Mortaliteten i lungemboli är upp till 20% (Goldhaber et al).
- 30% av patienter med venös tromboembolism får recidiv inom 10 år.
- 30–50% av all venös tromboembolism är oprovocerad. Resterande är provocerade av en eller multipla faktorer (se nedan).
Kardiopulmonella effekter av lungemboli
Kardiella effekter
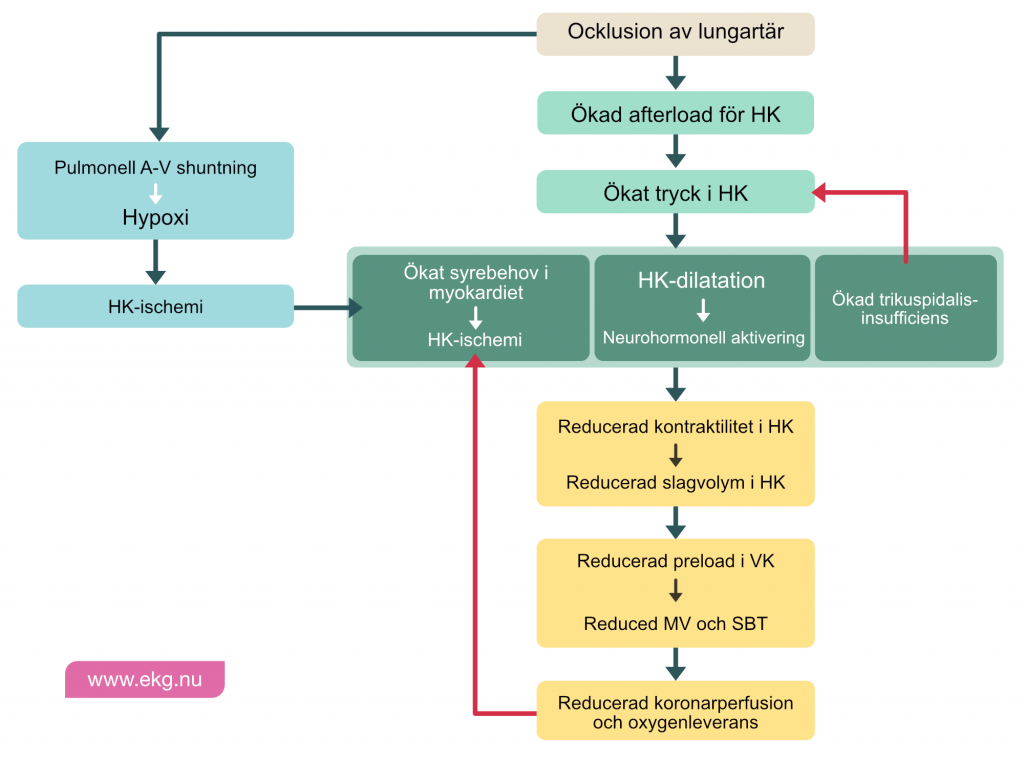
Lungemboli leder till ökat motstånd i lungartären (ökat afterload för höger kammare). Detta ökar belastningen på höger kammare, vars oxygenbehov stiger. Höger kammare kompenserar genom att dilatera (vilket sänker fyllnadstrycket i kammaren). Trots dilatationen kan belastningen leda till myokardischemi (oxygenbehov överstiger oxygenleverans). Långdragen och uttalad ischemi leder till högerkammarinfarkt. Oavsett om infarkt utvecklas eller inte så leder akut högerkammarbelastning till att kammarens slagvolymer minskar. När slagvolym minskar så pumpas mindre blod till vänster kammare, vars preload sjunker. Sjunkande preload leder till minskad cardiac output, sjunkande systoliskt blodtryck och därmed minskad koronarperfusion (koronart perfusionstryck). Detta leder till ännu sämre förutsättningar för höger kammare, vars slagvolymer sjunker ytterligare. Risken för hjärtstillestånd ökar med tillståndets duration. Pulslös elektrisk aktivitet (PEA) är vanligt vid hjärtstopp orsakat av lungemboli.
Pulmonella affekter
Obstruktion i lungartären leder till hypoxi i lungvävnad och pleura. Långdragen hypoxi resulterar i infarkt (lunginfarkt) och inflammation. Detta framkallar bröstsmärta, som ofta påminner om pleurit (andningskorrelerad, skarp bröstsmärta). Lunginfarkt leder till blödning i lungvävnaden, vilket kan orsaka hemoptys (blodig hosta).
Ocklusionen leder till ventilation-perfusion mismatch i lungan, vilket resulterar i minskat syrgastryck (PaO2) och hypoxi. En reflexmässig hyperventilation kan leda till respiratorisk alkalos med hypokapni (minskat PaCO2).
Diagnostik
Symptom på lungemboli
Majoriteten av alla med lungemboli har plötslig (akut) debut av symptom. I vissa fall kan symptomdebuten korreleras till en ändring i kroppsläge (t ex uppresning, fysisk aktivitet, etc).
Symptom är avhängiga av embolins hemodynamiska påverkan. Små embolier kan vara asymptomatiska, medan stora proximala ocklusioner kan ge cirkulatorisk kollaps och hjärtstillestånd. Sadelemboli innebär att tromben fastnat i arteria pulmonalis huvudförgrening och därmed ockluderar flöde till både höger och vänster lunga. Dessa embolier ger som regel uttalad hemodynamisk påverkan med hög mortalitet.

Bland patienter med bibehållen cirkulation är bröstsmärta, hosta, dyspné och takykardi de vanligaste symptomen. Symptomen är ospecifika och därför är det viktigt att medbringa lungemboli som differentialdiagnos vid akut bröstsmärta och/eller dyspné.
Kliniska fynd
- >50% har dyspné och takypné.
- 50% har bröstsmärta som är mer uttalad under inspiration
- Takykardi är den absolut vanligaste EKG-förändringen. S1Q3T3-mönster förekommer på EKG men har låg sensitivitet.
- Hosta
- Hemoptys (blodig hosta).
- Hypotension.
- Synkope / pre-synkope och cirkulatorisk påverkan talar mycket starkt för massiv lungemboli.
- Jugularisstas (vidgad vena jugularis).
- Subfebrilia.
- Eventuellt DVT-status i ben/bäcken.
Orsaker till lungemboli
- Djup ventrombos (DVT) är den vanligaste orsaken.
- Fettemboli ses efter kirurgi och ortopediska ingrepp.
- Cementemboli.
- Luftemboli.
- Fostervattenemboli.
- Vävnadsemboli.
- Tumöremboli.
- Bakteriell emboli.
Riskfaktorer för DVT och venös tromboembolism
Ökad koagulationsbenägenhet
- Hög ålder
- Cancer
- Antifosfolipidsyndrom
- Östrogenbehandling, p-piller
- Graviditet, post-partum
- Hereditet för tromboembolism
- Fetma, övervikt
- Dehydrering
- Inflammatorisk tarmsjukdom (Crohns sjukdom, ulcerös kolit)
- HIT (heparininducerad trombocytopeni)
Kirurgi, trauma, intervention
- Nyligen genomgången kirurgi
- Trauma, fraktur
- Implantation av CVK, pacemaker, ICD, CRT, etc
Immobilisering
- Sängliggande mer än vanligt, inklusive inläggning på sjukhus.
- Långvarigt sittande.
- Pares, paralys.
Ärftliga koagulationsrubbningar
- Faktor V Leiden mutation
- Mutation i prothrombin
- Mutation iantithrombin
- Brist på Protein C
- Brist på Protein S
Koagulationsrubbning skall misstänkas om patienten är ung, saknar riskfaktorer för tromboembolism, har hereditet eller får recidiv av tromboembolism.
Utredning av misstänkt lungemboli


Pre-test probability för lungemboli
Pre-test probability är en statistisk term som används för att vägleda val av utredning. Om pre-test probability för lungemboli är mycket hög så innebär det att det är mycket sannolikt att patienten har lungemboli, varför det kan vara onödigt att exempelvis analysera D-dimer och det är motiverat att göra datortomografi direkt. Om pre-test probability för lungemboli däremot är låg, så kan det vara olämpligt att genomföra datortomografi innan man vet om det faktiskt skett någon trombos i kroppen (dvs konstaterat att D-dimer är förhöjt).
Pre-test probability för lungemboli skall skattas med en av följande riskmodeller (score):
- Wells score
- Modifierad Wells score
- Geneva score
- PERC (pulmonary embolism rule-out criteria)
I Sverige används primärt Wells score, modifierad Wells score och PERC. Wells score och modifierad Wells score kan användas på alla med lungemboli. PERC används om man vill få ytterligare stöd för att utesluta lungemboli.
Varken score-system eller D-dimer kan med 100% säkerhet utesluta lungemboli. Om klinisk misstanke om lungemboli är hög skall patienten genomgå datortomografisk undersökning för att utesluta lungemboli.
Wells score för lungemboli
Denna variant av Wells score skall inte förväxlas med Wells score för DVT. Nedanstående score (riskmodell) används bara vid misstanke om lungemboli.
| TABELL 1. WELLS SCORE FÖR LUNGEMBOLI | POÄNG |
|---|---|
| Starkt misstänkt DVT* | 3 |
| Lungemboli mer sannolikt än andra diagnoser | 3 |
| Tidigare lungemboli / DVT | 1.5 |
| Takykardi (HR >100 / min) | 1.5 |
| Immobilisering eller kirurgi senaste 4 veckor | 1.5 |
| Hemoptys | 1 |
| Malignitet | 1 |
Bedömning av Wells score
Wells score, original
- 0-1 poäng: Låg sannolikhet (6%).
- 2–6 poäng: Intermediär sannolikhet (23%)
- ≥7 poäng: Hög sannolikhet (50%)
Wells score, modifierad
- ≤4 poäng: Lungemboli inte sannolikt (8%)
- ≥5 poäng: Lungemboli sannolikt (34%).
Geneva score för lungemboli
| TABELL 2. Geneva score | Poäng |
|---|---|
| Ålder >65 år | 1 |
| Tidigare DVT eller lungemboli | 3 |
| Nyligen genomgången kirurgi eller fraktur i nedre extremitet | 2 |
| Cancer i sjukhistorien | 2 |
| Ensidig bensmärta | 3 |
| Hemoptys | 2 |
| Hjärtfrekvens 75–94/min | 3 |
| Hjärtfrekvens ≥ 95/min | 5 |
| Palpationsmärta i ben med benödem | 4 |
Bedömning av Geneva score
- <4 poäng: låg sannolikhet för lungemboli (9%)
- 4–10 poäng: måttlig sannolikhet för lungemboli (26%)
- >10 poäng: hög sannolikhet för lungemboli (76%)
Pulmonary Embolism Rule-out Criteria (PERC)
Om sannolikheten för lungemboli är låg (enligt Wells score eller Geneva score) så kan PERC användas för att göra diagnosen ännu mer osannolik (alternativt utesluta lungemboli).
| TABELL 3. PERC score | Poäng |
|---|---|
| Ålder > 50 år | 1 |
| Hjärtfrekvens > 100/min | 1 |
| Syrgasmättnad (POX) < 95% | 1 |
| Hemoptys | 1 |
| Östrogenbehandling | 1 |
| Tidigare DVT eller lungemboli | 1 |
| Nyligen genomgången kirurgi eller trauma de senaste 4 veckorna | 1 |
| Ensidigt benödem | 1 |
Bedömning av PERC
- 0 poäng: låg sannolikhet (<1%). Lungemboli mycket osannolikt.
- ≥1 poäng: lungemboli är inte uteslutet och ytterligare utredning krävs.
D-dimer
D-dimer analyseras om sannolikheten för lungemboli är låg till måttlig. D-dimer har mycket hög känslighet för lungemboli (i princip alla lungembolier ger förhöjd D-dimer). Specificitet är dock låg, vilket förklaras av att D-dimer stiger oavsett orsak till trombos.
Normal D-dimer utesluter lungemboli (och DVT) om den kliniska misstanken är låg till måttlig. Om den kliniska misstanken om lungemboli är hög så får D-dimer inte användas för att utesluta lungemboli.
Andra blodprover
- Akutprover, inklusive njurfunktion och leverfunktion.
- Troponin (troponin T, troponin I) – Troponin analyseras för att klargöra om hjärtinfarkt föreligger. Vid lungemboli inträder högerkammarbelastning och stegrade troponinnivåer talar för att belastningen resulterat i myokardskada, vilket är prognostiskt ogynnsamt.
- Blodgas (artärgas) – Blodgas är inte en prioriterad undersökning vid misstanke om lungemboli. Om blodgas ändå rekvireras kan den visa resporatorisk alkalos, sänkt syrgastryck (PaO2) och förhöjt pH.
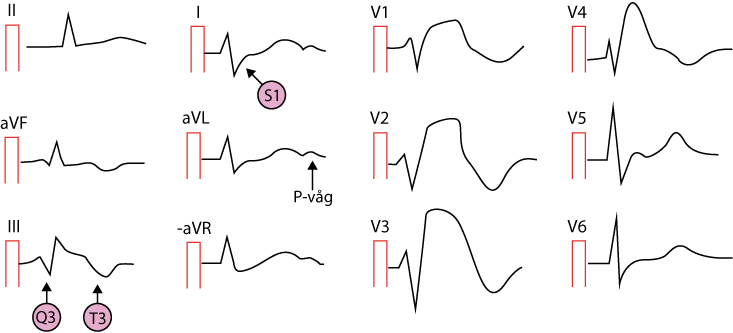
EKG vid lungemboli

EKG kan användas för att stärka misstanken om lungemboli. Sensitivitet och specificitet är låg för alla EKG-kriterier. Följande EKG-förändringar kan föreligga vid lungemboli:
- Sinustakykardi är den vanligaste EKG-förändringen vid lungemboli.
- S1Q3T3-mönster, vilket innebär att det ses en djup S-våg i avledning I samt Q-våg och T-vågsinversion i avledning III.
- T-vågsinversion (negativa T-vågor) i V1-V4.
- Nytillkommet högergrenblock (komplett eller inkomplett).
- Nytillkommet förmaksflimmer, förmaksfladder eller förmakstakykardi.
- ST-höjning eller ST-sänkning i V1-V3.
- Sinusbradykardi förekommer.
- P-pulmonale
- Högerställd el-axel
Datortomografi lungartärer (DTLA, CT, DT)
Förkortningarna DTLA, CT och DT används synonymt här.
Datortomografisk undersökning av lungartären är förstahandsval för att utreda misstänkt lungemboli. Undersökningen kräver kontrast. Metoden är snabb, har hög sensitivitet och hög specificitet. Lungemboli konstateras vid förekomst av kontrastdefekt i lungartären och/eller dess grenar. Även indirekta tecken på lungemboli kan ses, dvs pleuravätska eller kilformad lunginfarkt.
Datortomografi bör inte göras i följande situationer:
- Vid graviditet.
- Om patienten har kontrastallergi.
- Vid njursvikt.
Lungskintigrafi
Lungskintigrafi görs om patienten är gravid, har njursvikt eller kontrastallergi. Undersökningen är tidskrävande. Med radioaktiva markörer kartläggs lungornas perfusion (genomblödning) och ventilation. En lokal skillnad, mismatch, i ventilation och perfusion talar för lungemboli (dvs ett område är ventilerat men inte perfunderat).
Ekokardiografi
Ekokardiografi kan visualisera indirekta tecken på lungemboli. Ocklusion i lungartären leder till stegrade tryck på höger sida. Tecken på stegrade tryck är som följer:
- Ökad trikuspidalisinsufficiens.
- Stegrat PASP (systoliskt PA-tryck).
- Vidgad vena cava inferior, utan respiratorisk variation.
- Vidgad höger kammare.
- Paradoxal rörelse av septum.
Övriga bildgivande metoder
Slätröntgen thorax bör inte göras vid misstanke om lungemboli eftersom det kan fördröja tid till definitiv diagnos.
Angiografi görs i utvalda fall, särskilt om endovaskulär behandling planeras.
Magnetkamera har hög sensitivitet och specificitet och kan göras om diagnosen är oklar eller om andra modaliteter inte är lämpliga.
Behandling av lungemboli
I akutskedet styrs behandlingen av patientens tillstånd. Allvarlig lungemboli (sk massiv lungemboli) behandlas med akut antikoagulation och reperfusion. Övriga lungembolier behandlas med antikoagulation.
Allvarlig (massiv lungemboli) definieras som lungemboli som uppfyller följande kriterier:
- Systoliskt blodtryck <90 mm Hg.
- Systoliskt blodtrycksfall >40 mm Hg.
Andra varningstecken:
- Embolier som ockluderar minst två lobartärer.
- Påverkad hemodynamik, takykardi, hypotension. Yrsel. Svimning.
- Högerkammardilatation, förhöjt PASP (systoliskt PA-tryck).
- Avplanad septum, invers rörelse.
- Vidgad höger kammare på CT.
- Förhöjt BNP, NT-proBNP, troponin.
Riskstratifiering med PESI (Pulmonary Embolism Severity Index)
PESI estimerar risken för 30-dagarsmortalitet bland patienter med konstaterad lungemboli. Riskskattningen används för att vägleda det initiala omhändertagandet.
| TABELL 4. PESI | Poäng |
|---|---|
| Ålder | 1 poäng per år |
| Cancer i sjukhistorien | 30 |
| Systoliskt blodtryck < 100 mm Hg | 30 |
| Hjärtfrekvens ≥ 110/min | 20 |
| Syrgasmättnad (POX) < 90% | 20 |
| Hjärtsvikt | 10 |
| Lungsjukdom | 10 |
| Mental påverkan | 60 |
| Kroppstemperatur < 37°C | 20 |
| Andningsfrekvens ≥ 30/min | 20 |
| Manligt kön | 10 |
Bedömning av PESI-score:
| Klass | Poäng | Risk | Mortalitet | Sjukhus-mortalitet |
|---|---|---|---|---|
| Klass I | <66 poäng | Väldigt låg risk | 0–1.6% | ≤1.1% |
| Klass II | 66-85 | Låg risk | 1.7–3.5% | ≤1.9% |
| Klass III | 86–105 | Intermediär risk | 3.2–7.1% | ≤4.7% |
| Klass IV | 106–125 | Hög risk | 4.0–11.4% | ≤7.0% |
| Klass V | > 125 points | Väldigt hög risk | 10.0–23.9% | ≤17.2% |
Behandling av lungemboli med instabil hemodynamik
Lungemboli med hög risk (>15% mortaltiet inom 30 dagar) är synonymt med massiv lungemboli. Dessa patienter har systolist blodtryck <90 mm Hg, alternativt >40 mm Hg blodtrycksfall (systoliskt). Dessa patienter behöver i de flesta fall trombolys. Omedelbar ekokardiografi (TTE) och datortomografi är viktig.
Åtgärder
- Starta infusion med lågmolekylärt heparin (enoxaparin).
- Ge syrgas om syrgasmättnad <95%.
- Ge bolus (500 ml) vätska, t ex Ringer-Acetat eller NaCl om höger kammare klarar det.
- Ge inotropt stöd om fortsatt hypotensiv.
- Klargör om det finns kontraindikationer mot trombolys. Om inga kontraindikationer föreligger ges Alteplas (Actilyse):
- intravenöst 10 mg på 2 min och 90 mg infusion på 120 minuter.
- om patient väger <65 kg är dosen max 1.5 mg/kg.
- Heparininfusion pausas under trombolys och startas tidigast 60 minuter efter avslutad Alteplasinfusion.
- Se FASS eller lokalt vårdprogram.
Kateterburen lokal trombolys och endovaskulär trombektomi är alternativ till systemisk trombolys. De kan också erbjudas om trombolys inte ger önskvärd effekt. Kirurgisk trombektomi är ett fjärde alternativt.
Behandling av lungemboli med stabil hemodynamik
Antikoagulation görs idag med nya antikoagulantia (NOAK), som resulterar i 30% färre allvarliga blödningar, jämfört med warfarin. Om långtidsbehandling skall ges med Pradaxa (dabigatran) eller Lixiana (edoxaban) så behövs 5 dagar behandling med lågmolekylärt heparin. Om långtidsbehandling ges med Xarelto (rivaroxaban) eller Eliquis (Apixaban) behövs inte lågmolekylärt heparin.
Lågmolekylärt heparin kan ges i form av enoxaparin om patienten har normal njurfunktion. Lågmolekylärt heparin föredras som långtidsbehandling för patienter med cancer. Ofraktionerat heparin (UFH) ges till patienter med nedsatt njurfunktion samt patienter som senare kan behöva trombolys.
Långtidsbehandling
- Lågmolekylärt heparin föredras för gravida, samt patienter med cancer.
- För warfarin är terapeutiskt PK-INR 2–3.
- NOAK-doser (3–6 månader behandling):
- Pradaxa (dabigatran) 150 mg x 2 eller
- Lixiana (edoxaban) 60 mg x 1 eller
- Xarelto (rivaroxaban (Xarelto) 15 mg x 2 i 21 dagar, därefter 20 mg eller
- Eliquis (apixaban) 10 mg x 2 i 7 dagar, därefter 5 mg x 2.
Bedömning av blödningsrisk
Det finns ingen specifik riskmodell framtagen för lungemboli. Oftast används HAS-BLED, som dock är framtagen för bedömning av blödningsrisk inför behandling av förmaksflimmer. Riskfaktorer för blödning är som följer:
- Hög ålder
- Frailty (skör patient)
- Fallbenägenhet
- Tidigare blödning
- Cancer
- Njursvikt
- Leversvikt
- Trombocytopeni
- Stroke
- Diabetes
- Anemi
- Behandling med trombocythämmare
- Behandling med NSAID
- Nyligen genomgången kirurgi
Kontraindikationer mot trombolys
Absoluta kontraindikationer
- Strukturell intrakraniell sjukdom
- Tidigare hjärnblödning
- Tidigare ischemisk stroke inom 3 månader
- Pågående blödning
- Nyligen genomgången spinalkirurgi eller hjärinkururg
- Nyligen huvudtrauma eller hjärnskada
- Blödningsdiates
Relativa kontraindikationer mot trombolys
- Blodtryck >180 mm Hg eller diastoliskt >110 mm Hg
- Nyligen blödning (ej intrakraniell)
- Nyligen genomgången kirurgi
- Nyligen genomgången invasiv procedur
- Ischemisk stroke >3 månader sedan
- Pågående användning med antikoagulantia
- Perikardeffusion
- Diabetesretinopati
- Graviditet
- Ålder >75 år
- Kroppsvikt <60 kg
Komplikationer till lungemboli
- Pulmonell hypertension drabbar <5%.
- Hjärstilleståld (typiskt med PEA, pulslös elektrisk aktivitet).
- Högerkammarsvikt (se Hjärtsvikt).
- Lunginfarkt (10% av fallen).
- Pleuraeffusion
- Posttrombotiskt syndrom (30%).
Referenser
Di Nisio et al. Deep vein thrombosis and pulmonary embolism. Lancet 2016;388:3060-73
Raskob GE, Angchaisuksiri P, Blanco AN, et al. Thrombosis:
a major contributor to global disease burden. Arterioscler Thromb Vasc Biol 2014; 34: 2363–71
Heit JA. Epidemiology of venous thromboembolism. Nat Rev Cardiol 2015; 12: 464–74.
Goldhaber SZ, Visani L, De Rosa M. Acute pulmonary embolism: clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER). Lancet 1999; 353: 1386–89.
Konstantinides et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society. European Heart Journal (2020) 41, 543603.
Ekdahl et al. Lungemboli. Internetmedicin.

