STEMI (ST-höjningsinfarkt) – EKG, Diagnos, Kriterier, Behandling och Uppföljning
Diagnostik och handläggning av STEMI (ST-höjningsinfarkt)
En sammanställning av rekommendationer från European Society for Cardiology (ESC) finns i artikeln Riktlinjer för behandling av STEMI.
Akut hjärtinfarkt med ST-höjning (ST-höjningsinfarkt) är den allvarligaste manifestationen av akut kranskärlssjukdom. I detta kapitel diskuteras patofysiologi, definitioner, kriterier och handläggning av patienter med ST-höjningsinfarkt. Definitioner och kliniska rekommendationer som presenteras i detta kapitel är i linje med guidelines publicerade av European Society for Cardiology. Dessa rekommendationer baseras på en lång rad randomiserade kliniska prövningar och flera decennier av forskning och observationer i klinisk praxis (Nabel et al.).
Exempel på EKG vid ST-höjningsinfarkt (STEMI)
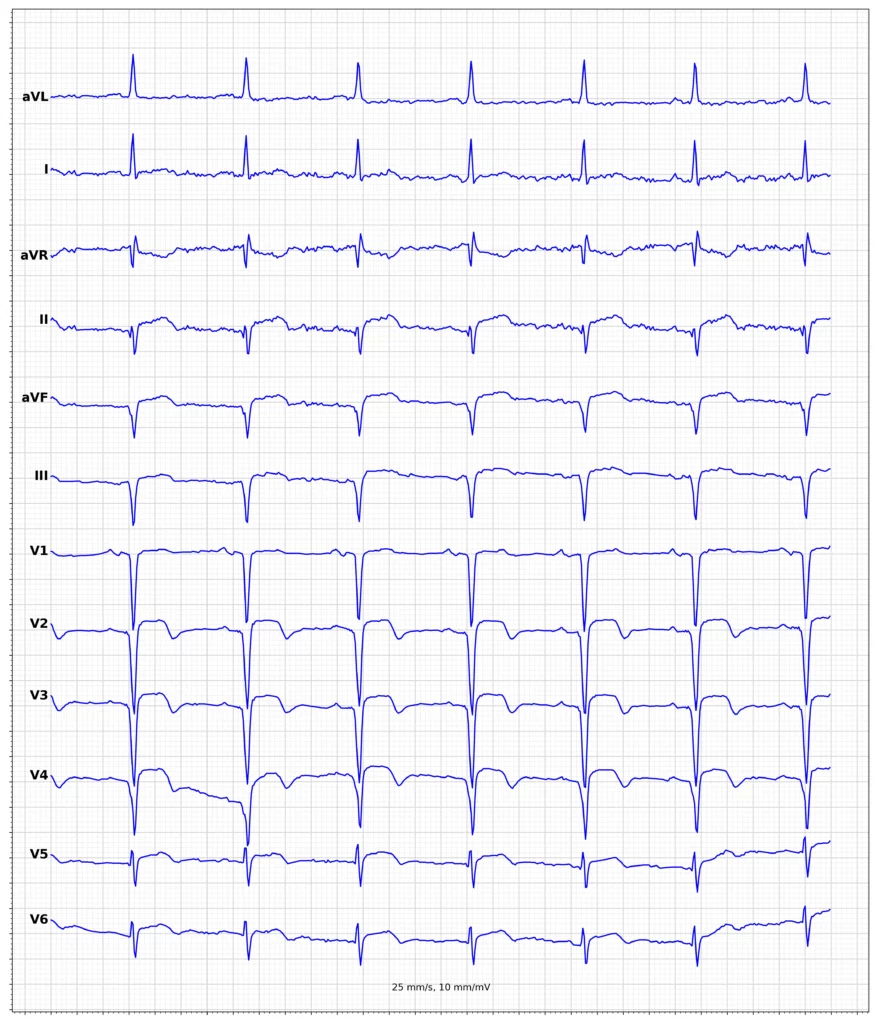
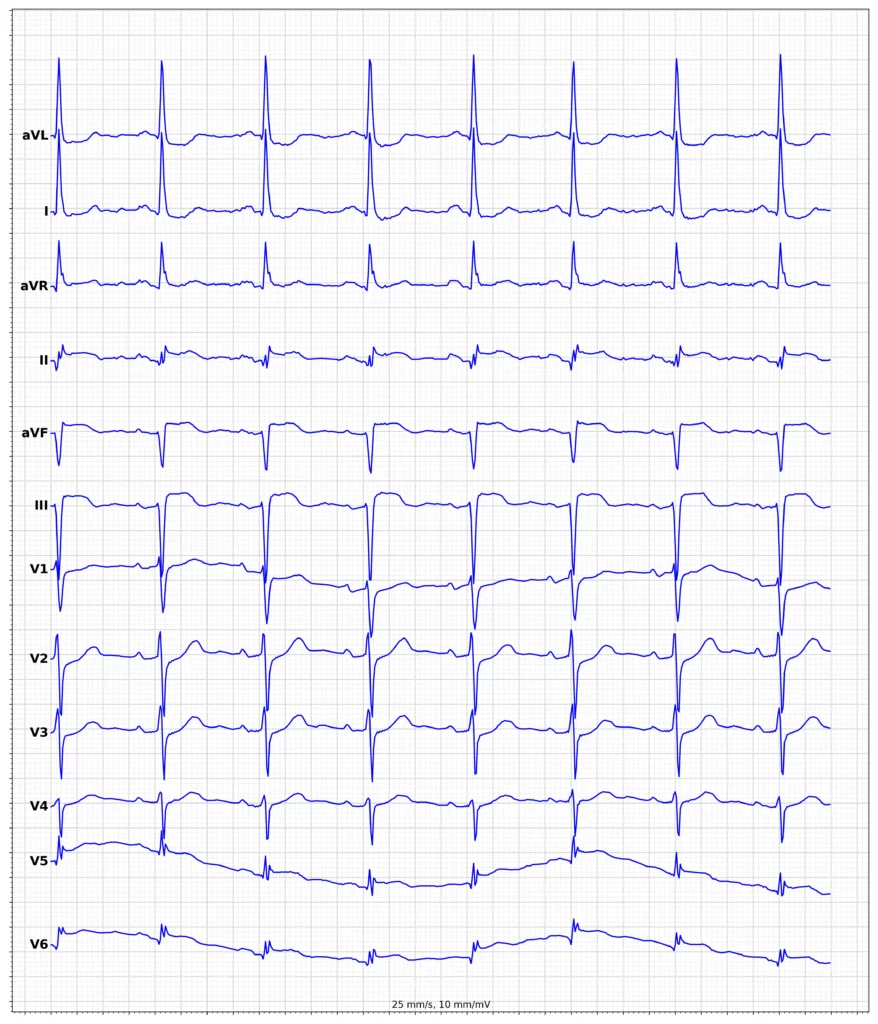
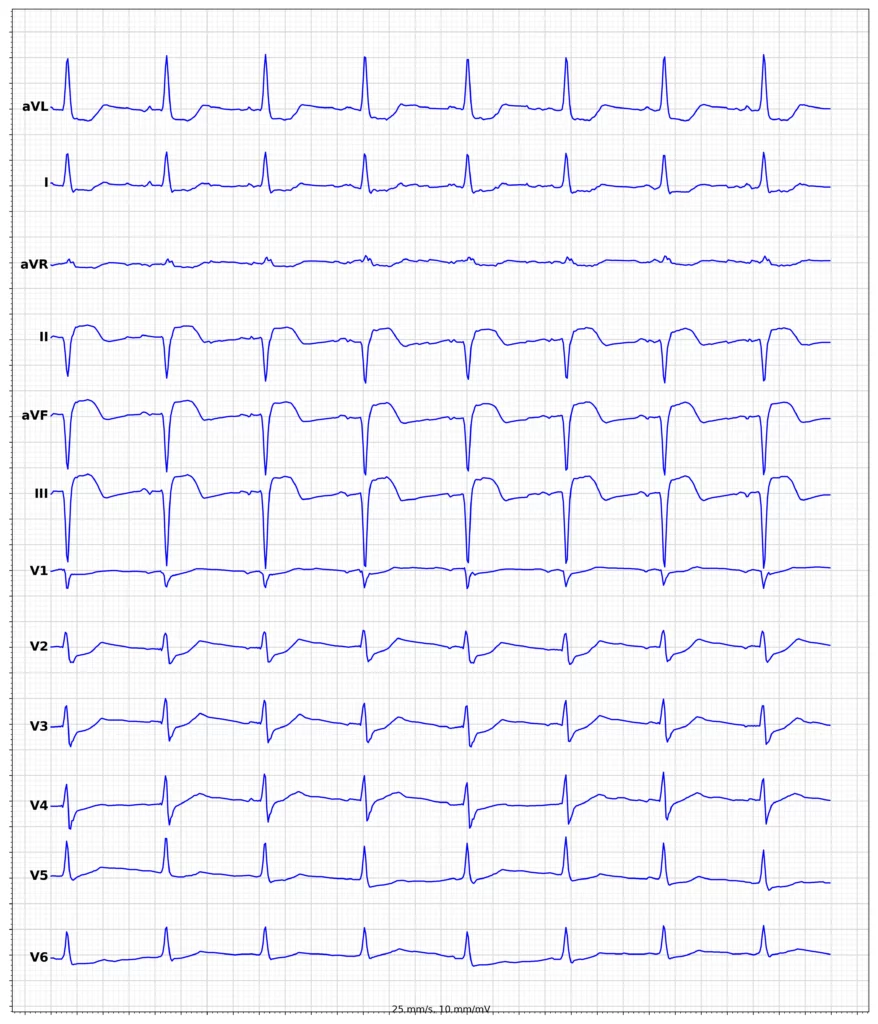
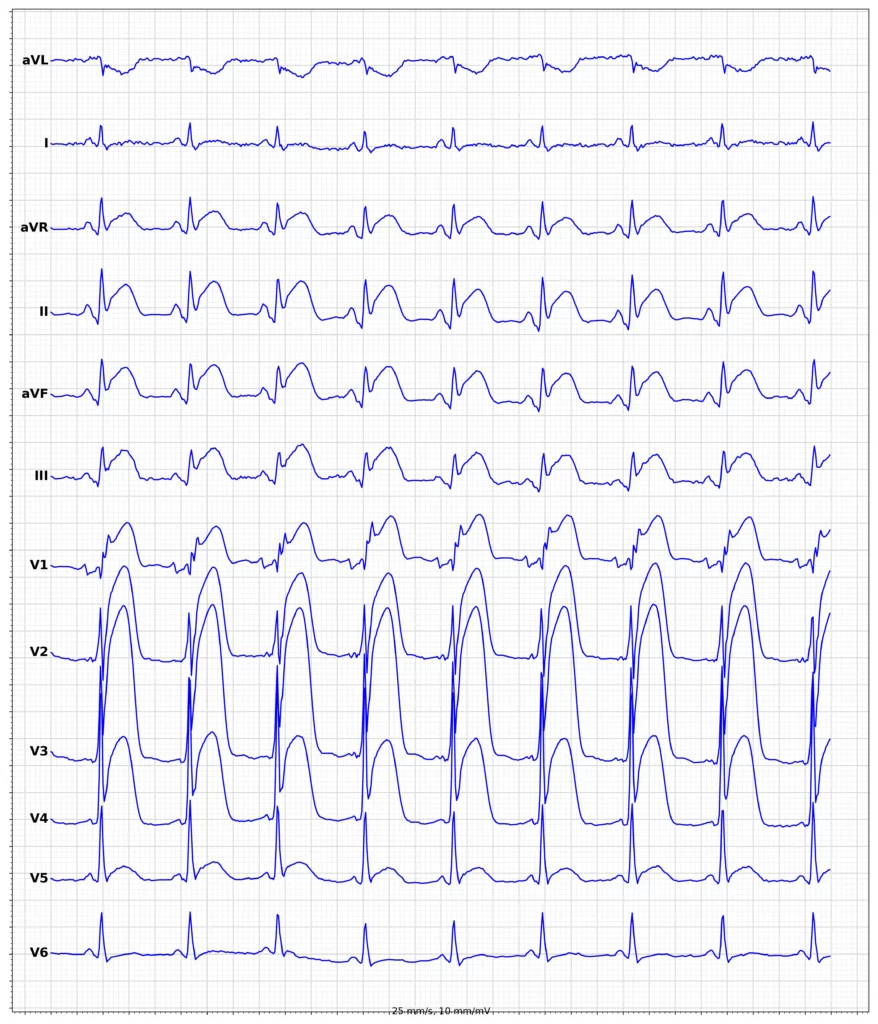
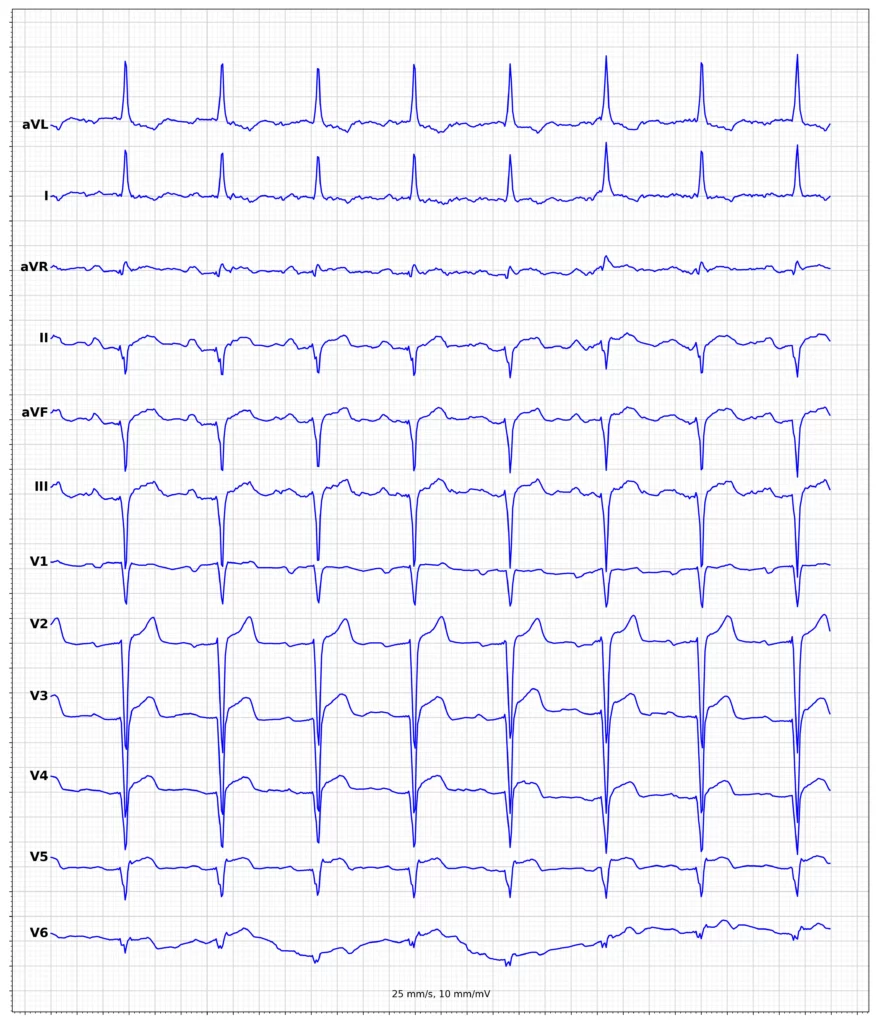
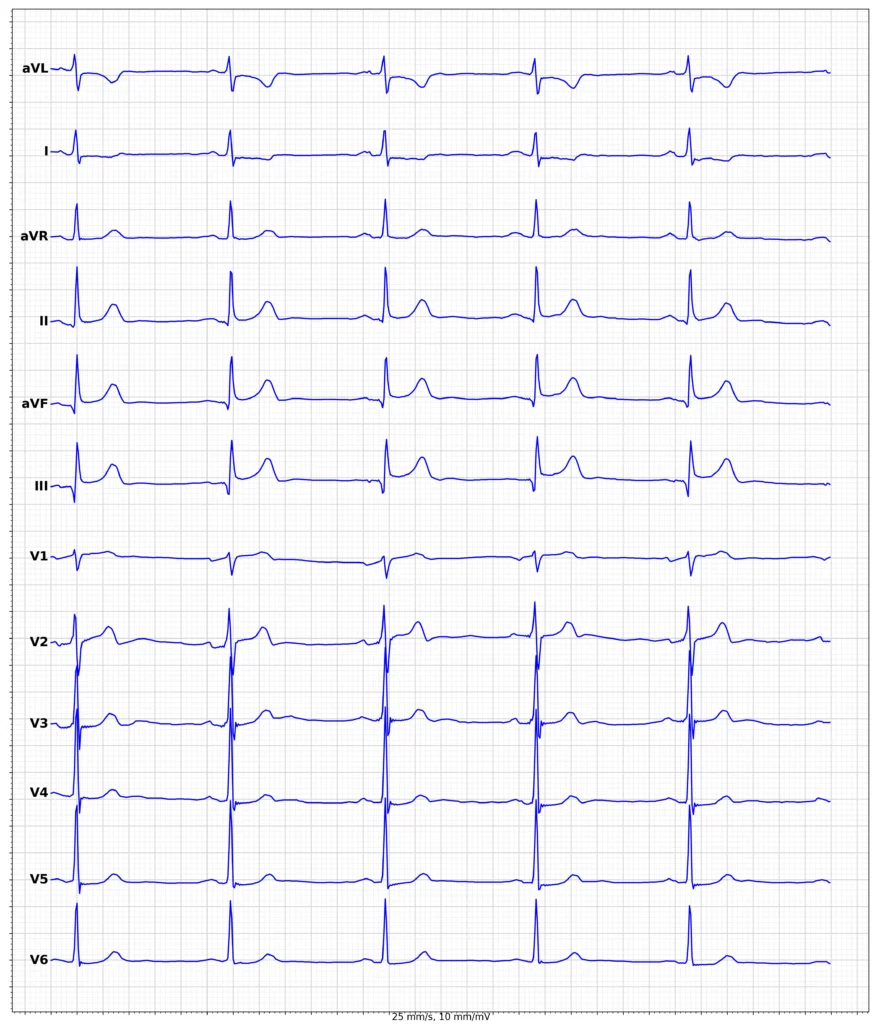
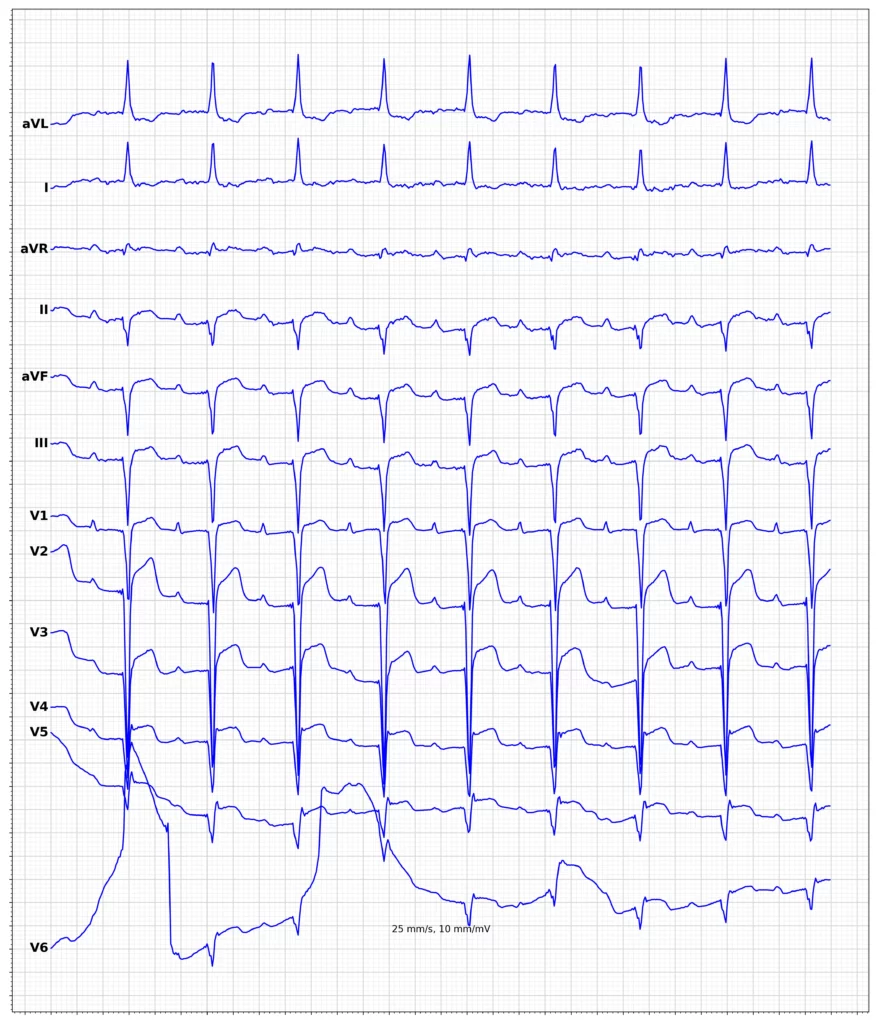
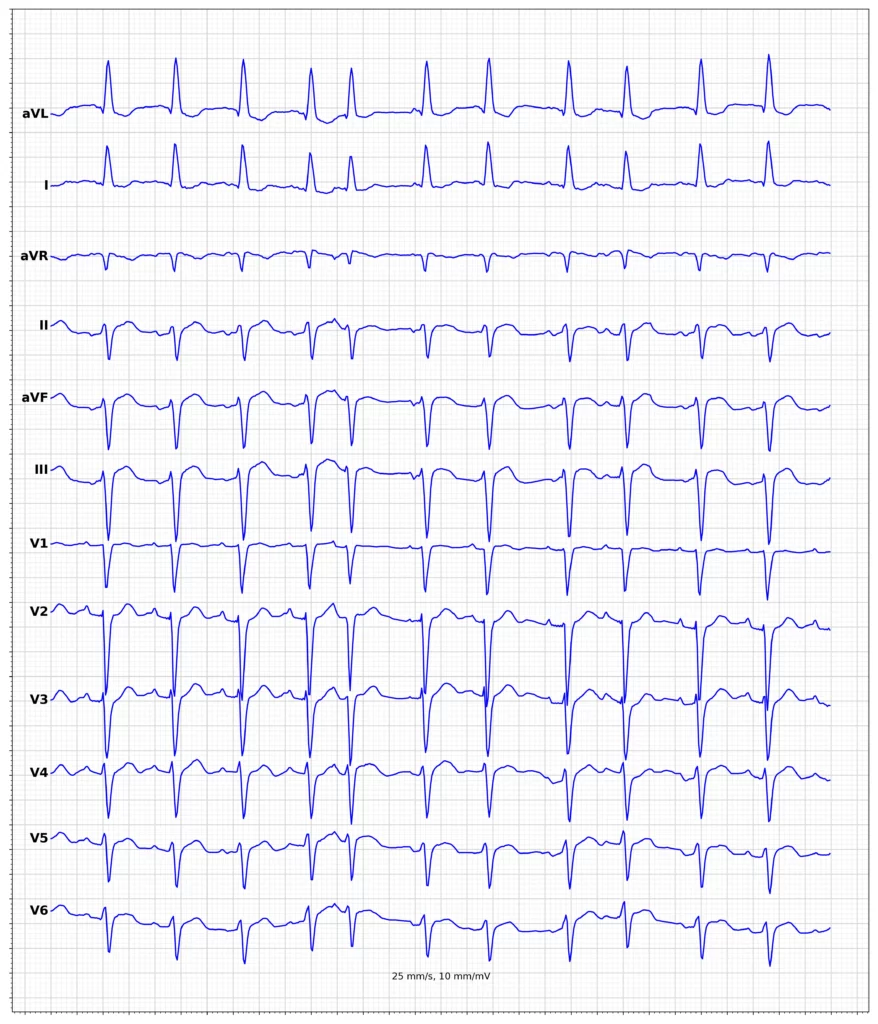
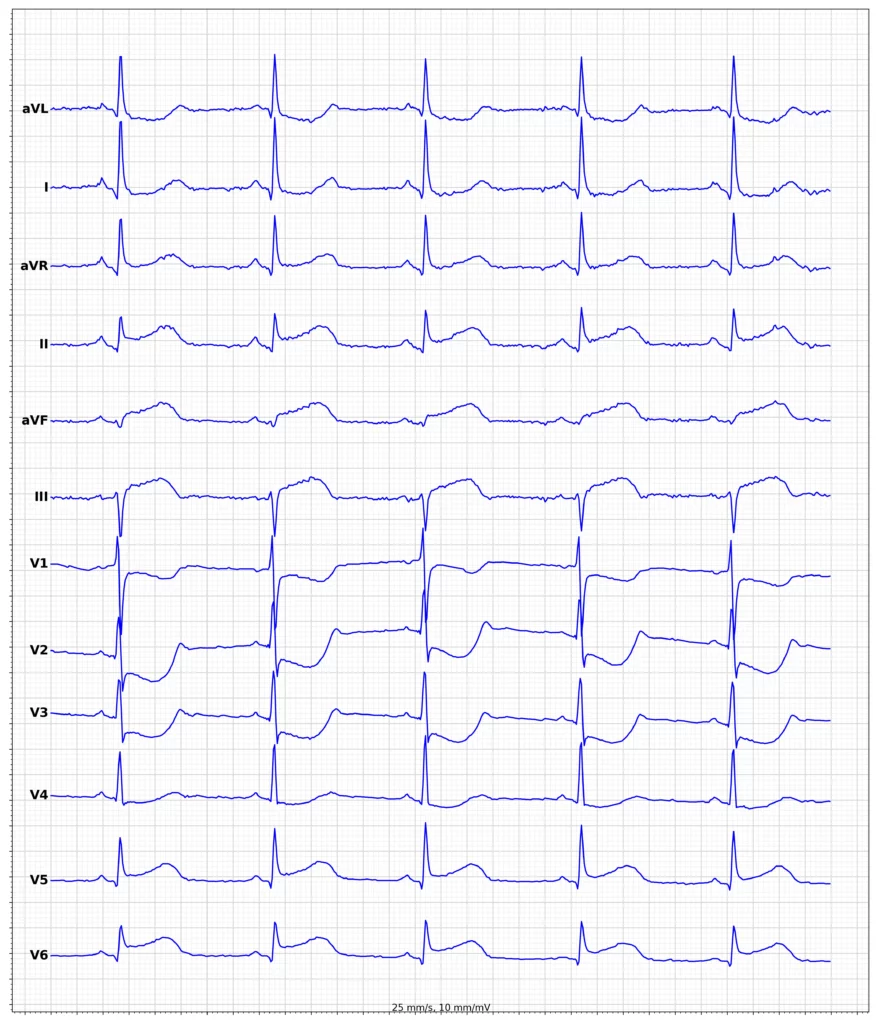
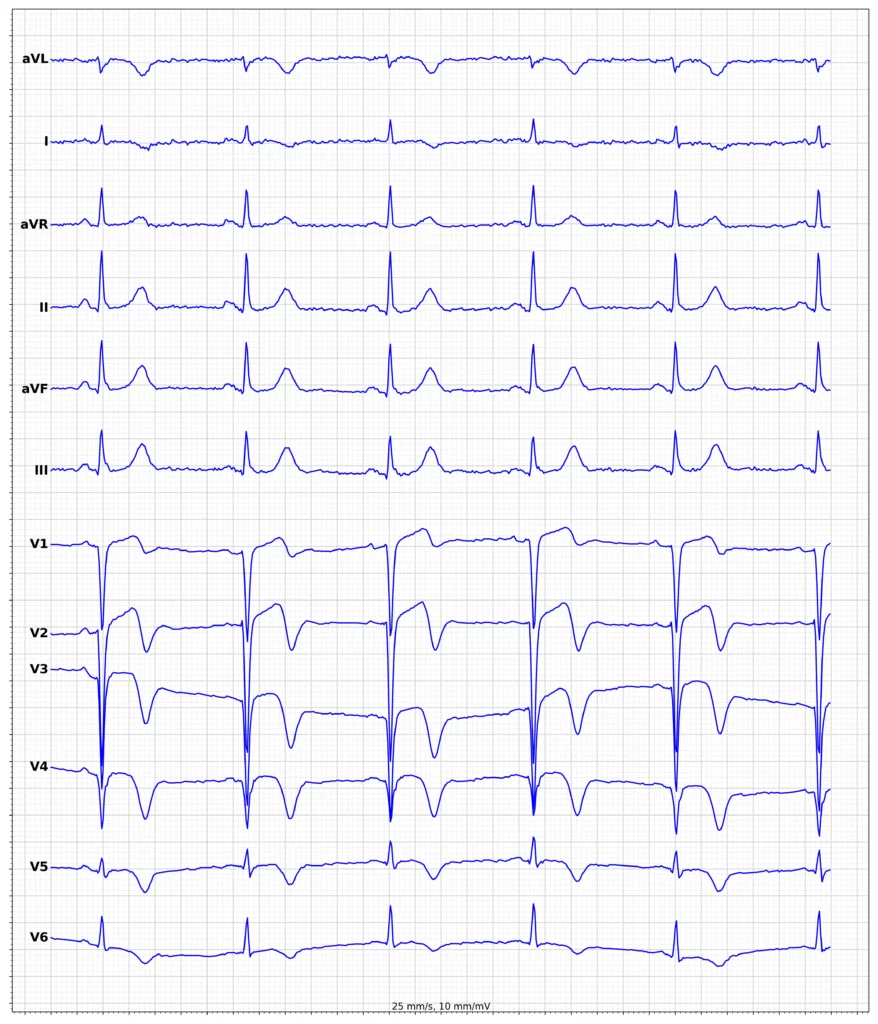
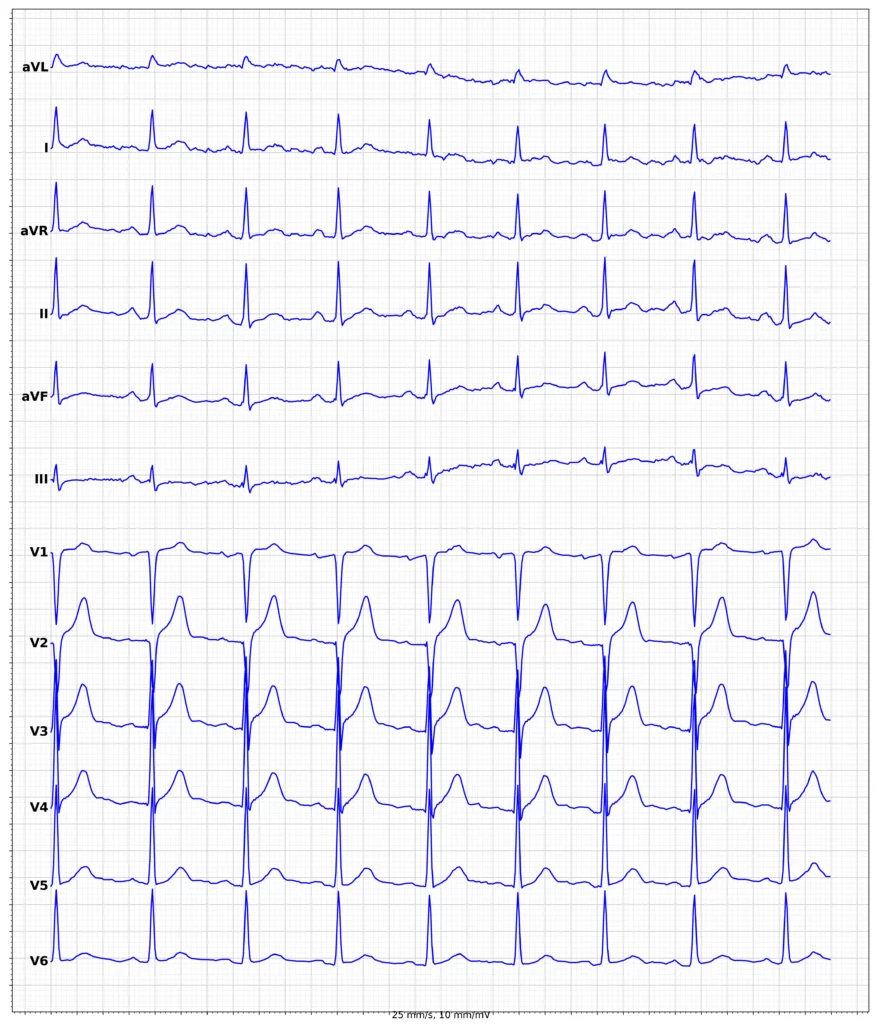
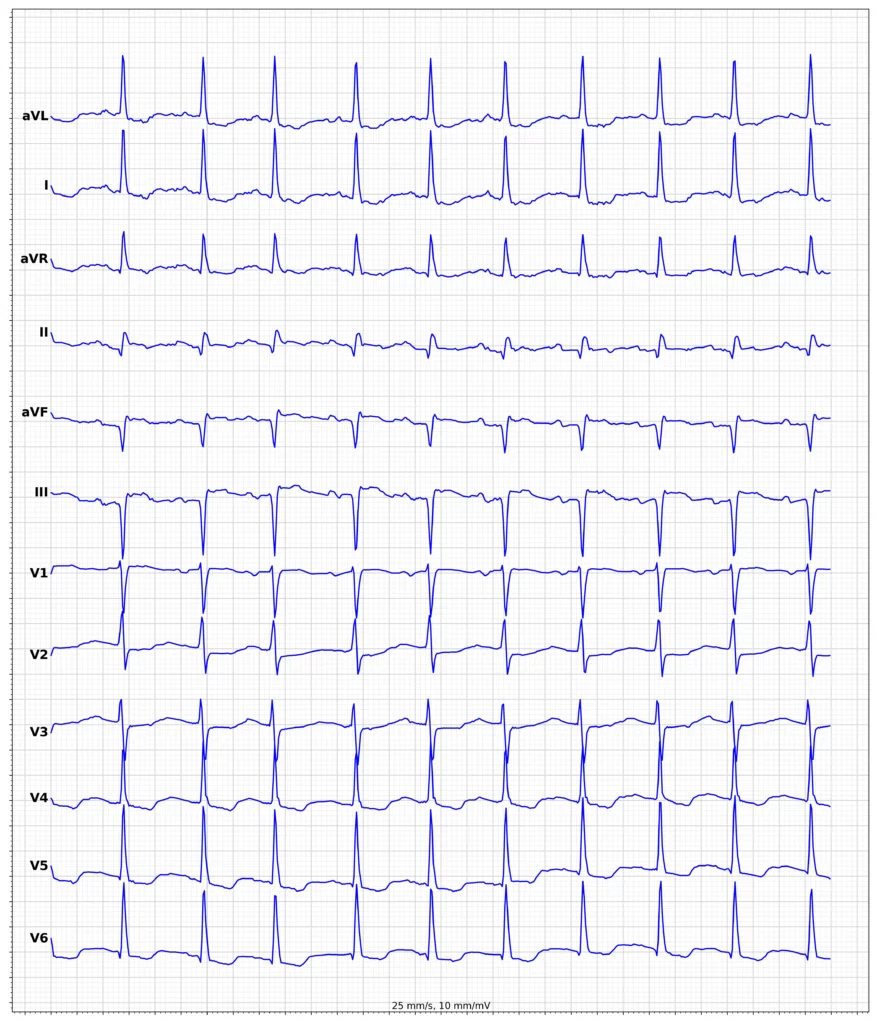
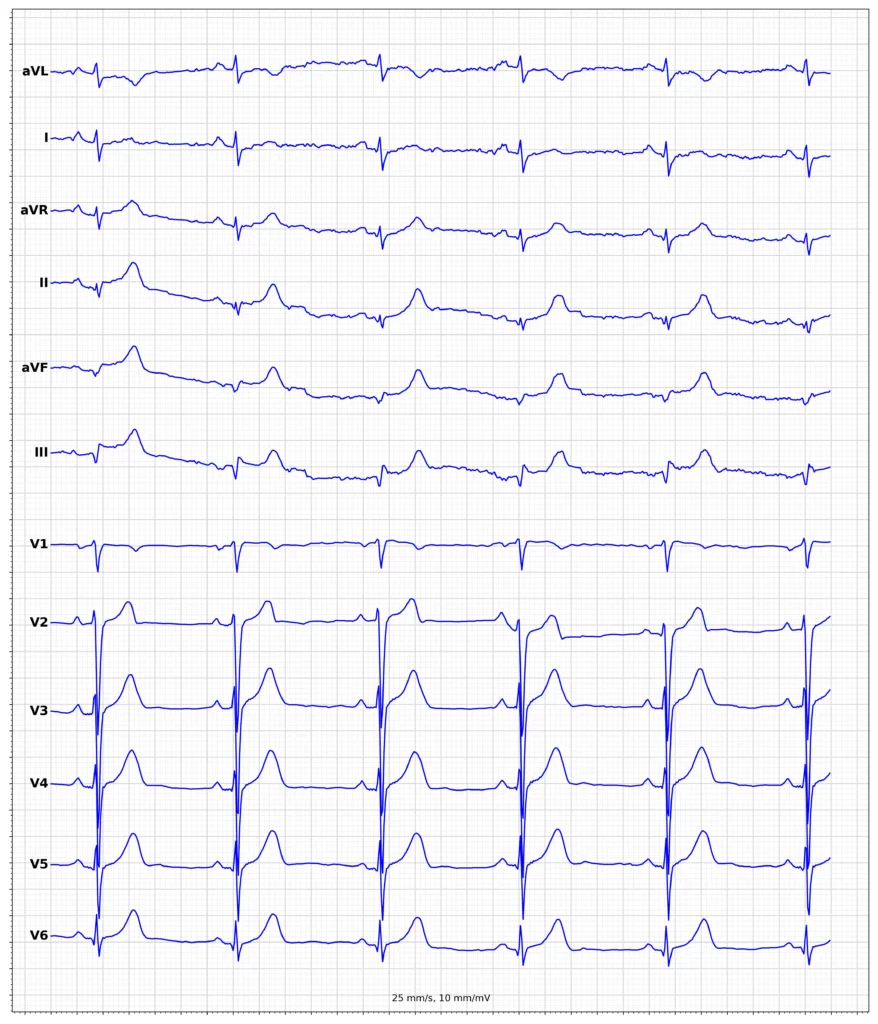
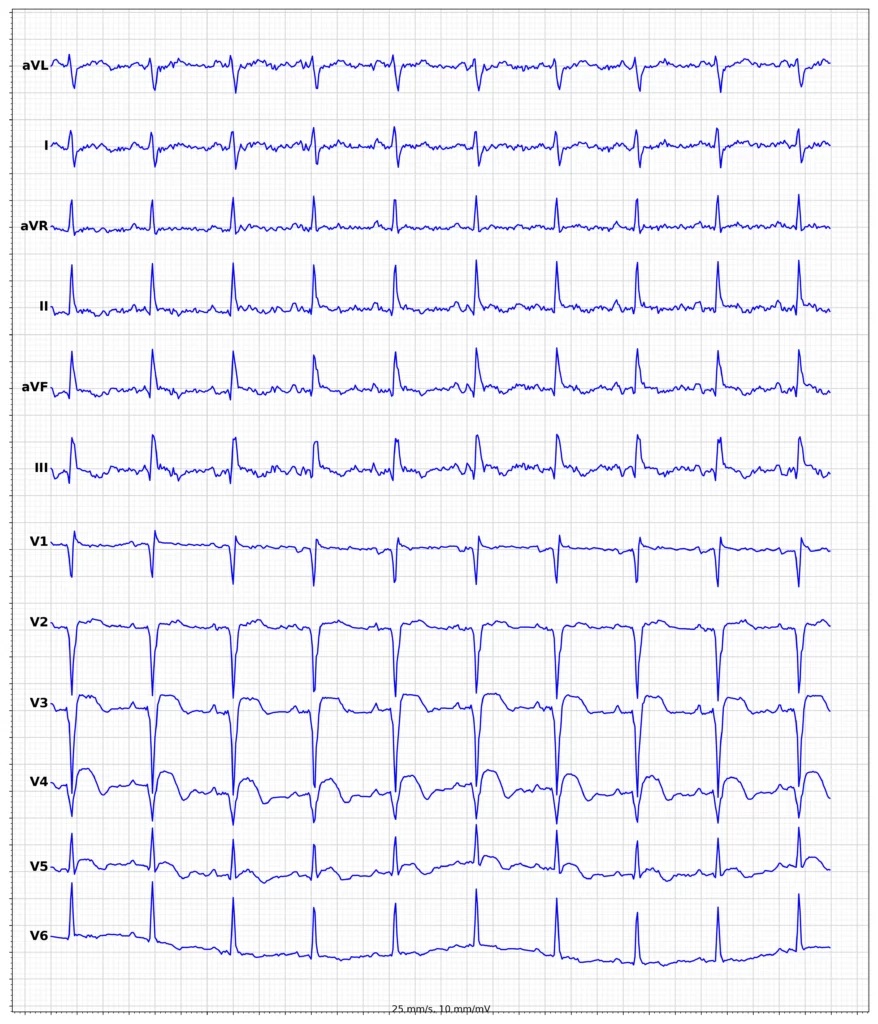
Klinisk presentation vid ST-höjningsinfarkt (STEMI)
Bröstsmärta (eller obehag kring bröstet) är det främsta symtomet på myokardischemi och är särskilt uttalat hos patienter som drabbats av ST-höjningsinfarkt (STEMI). Att symtomen är mer uttalade vid ST-höjningsinfarkt, jämfört med icke-ST-höjningsinfarkt (NSTEMI) eller instabil angina förklaras av att ischemin är mer omfattande vid ST-höjningsinfarkt. Vid ST-höjningsinfarkt föreligger en fullständig ocklusion av ett epikardiellt kranskärl, vilket leder till transmural ischemi (dvs. ischemi från endokardium till epikardium i det drabbade området). Detta innebär att ischemin är omfattande och bröstsmärtan därför mer uttalad. Vid NSTEMI och instabil angina föreligger oftast en partiell (subtotal) ocklusion, vilket innebär att det finns ett kvarstående, men kraftigt reducerat, blodflöde i kranskärlet. Detta orskar subendokardiell ischemi, som därmed är lindrigare. Av samma anledning löper patienter med STEMI högre risk att drabbas av livshotande ventrikulära arytmier i akutskedet. Ventrikeltakykardi (VT) och ventrikelflimmer (VF) kan uppstå när som helst efter att ocklusionen uppkommit. En ventrikulär arytmi (VT, VF) är den vanligaste dödsorsaken vid STEMI. Dödsfall på grund av kammardysfunktion (akut hjärtsvikt, kardiogen chock) eller mekaniska komplikationer är betydligt ovanligare.
Vårdkedjan vid ST-höjningsinfarkt
Optimal handläggning av patienter med STEMI kräver ett välkoordinerat system som omfattar både pre-hospital och sjukhusbaserad vård. I större samhällen har regionala vårdkedjor etablerats för att snabbt identifiera och behandla patienter med STEMI. Detta bygger på ett sömlöst samarbete mellan larmcentralen, ambulanssjukvården, akutmottagningen, PCI-lab och hjärtintensivvårdsavdelningen (HIA). Alla komponenter i vårdkedjan måste samarbeta effektivt för att säkerställa snabb och korrekt behandling.
Pre-hospital diagnostik av ST-höjningsinfarkt (STEMI)
Diagnosen är relativt enkel att ställa med hjälp av 12-avlednings-EKG. Ambulanspersonal har visat sig vara mycket kapabla att diagnostisera STEMI genom pre-hospitalt EKG. Sensitivtet, specificitet, positivt prediktivt värde (PPV) och negativt prediktivt värde (NPV) för att diagnostisera STEMI är som följer (Ducas et al, Mencl et al.):
- Sensitivitet: Ambulanspersonal uppvisar relativt hög känslighet när det gäller att upptäcka STEMI; i en studie var sensitiviteten 75%.
- Specificitet: Specificiteten är relativt låg (53 %), vilket indikerar svårigheterna att differentiera STEMI från andra tillstånd som orsakar ST-höjningar på EKG.
- Positivt prediktivt värde (PPV): PPV är 59.5%, vilket indikerar att något mer än hälften av de fall som tolkas som STEMI av ambulanspersonal faktiskt är STEMI.
- Negativt prediktivt värde (NPV): NPV är mycket högt (99.7%), vilket tyder på att ambulanspersonalen är mycket tillförlitlig när det gäller att utesluta STEMI.
Således föreligger både styrkor och begränsningar beträffande pre-hospital diagnostik av ST-höjningsinfarkt. Förmågan att utesluta STEMI är mycket hög, medan förmågan upptäcka fallen och särskilja de från differentialdiagnoser kan förbättras ytterligare (Mencl et al.).
Analys av troponiner vid STEMI
Analys av troponiner är inte nödvändigt för att diagnostisera akut STEMI, eftersom diagnosen baseras på den kliniska bilden och ST-höjningar på EKG. Troponiner analyseras ändock rutinmässigt så snart den kliniska situationen tillåter det.
Principer för behandling av ST-höjningsinfarkt (STEMI)
Behandling av STEMI inbegriper en kombination av antiischemiska läkemedel, trombocythämmare, antikoagulantia och reperfusion genom perkutan koronar intervention (PCI) eller fibrinolys. Reperfusion är avgörande och måste inledas omedelbart, eftersom STEMI orsakas av en fullständig ocklusion som kräver återställning av blodflödet. I princip samtliga patienter med akut STEMI bör genomgå omedelbar koronarangiografi, med mål att utföra PCI. En lång rad randomiserade studier visar att trombocythämmare, antikoagulantia och reperfusion minskar morbiditet och mortalitet. En översikt över reperfusionsstrategier vid akuta koronara syndrom framgår i Figur 1.
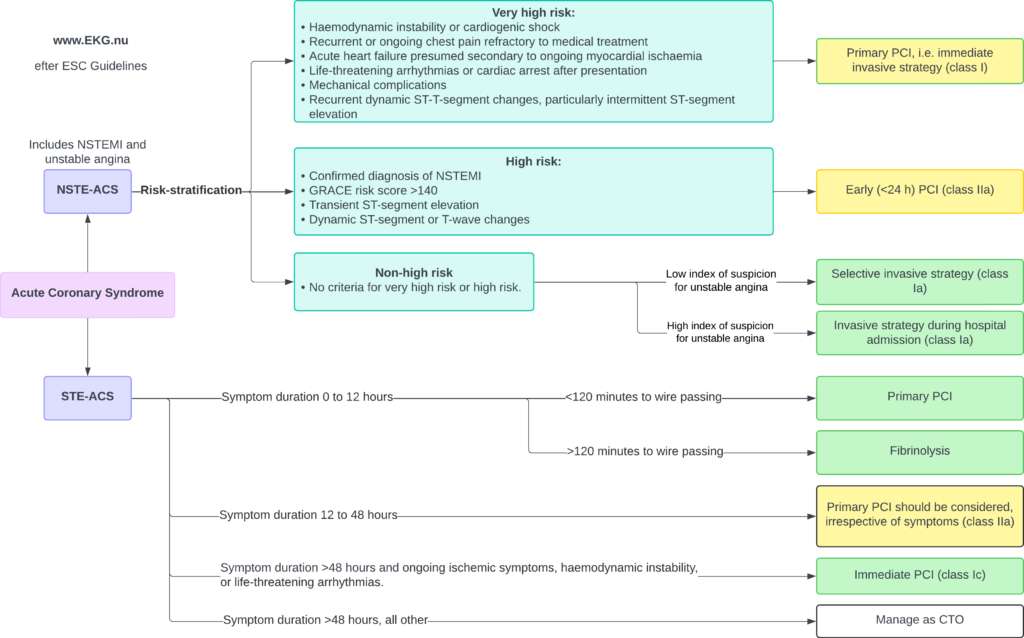
Definition av ST-höjningsinfarkt (STEMI)
ST-höjningsinfarkt (STEMI) är ett akut koronart syndrom (AKS). Det finns två typer av akuta koronara syndrom (Thygesen et al.):
- STE-AKS (AKS med ST-höjning) föreligger om EKG visar signifikanta ST-höjningar. Om en patient med sådana EKG-förändringar utvecklar en hjärtinfarkt (dvs har förhöjda troponinnivåer i blodet) klassificeras tillståndet som STEMI (ST-höjningsinfarkt). I klinisk praxis är dock STE-AKS och STEMI likvärdiga eftersom närmast alla patienter med bröstsmärta och ST-höjningar på EKG utvecklar förhöjda troponinnivåer.
- NSTE-AKS (AKS utan ST-höjning) definieras genom avsaknad av signifikanta ST-höjningar på EKG. Alla patienter som inte uppfyller EKG-kriterier för STEMI klassificeras automatiskt som NSTE-AKS. Majoriteten av dessa patienter kommer att uppvisa förhöjda troponinnivåer, vilket klassificerar tillståndet som NSTEMI (icke-ST-höjningsinfarkt). De som inte uppvisar förhöjda troponinnivåer klassificeras som instabil angina pectoris (UA, unstable angina). Patienter med NSTE-AKS uppvisar vanligen ST-sänkningar och/eller T-vågsinversioner.
Klassifikation av akuta koronara syndrom framgår i Figur 2.

Diagnosen akut hjärtinfarkt kräver att det finns bevis på myokardnekros. Även om flera hjärtavbildande modaliteter kan klargöra detta (särskilt magnetkamera-undersökning, MR hjärta), så används troponiner för att konstatera myokardnekros. Skillnaden mellan AKS med ST-höjning (STE-AKS, eller STEMI) och AKS utan ST-höjning (NSTE-AKS, som omfattar NSTEMI och instabil angina) är enbart förekomsten av ST-höjningar på EKG. Denna tämligen simpla distinktion differentierar dock två olika tillstånd, varav det ena (STE-AKS) orsakas av en total ocklusion som kräver reperfusion (PCI, fibrinolys).
Patofysiologi vid ST-höjningsinfarkt (STEMI)
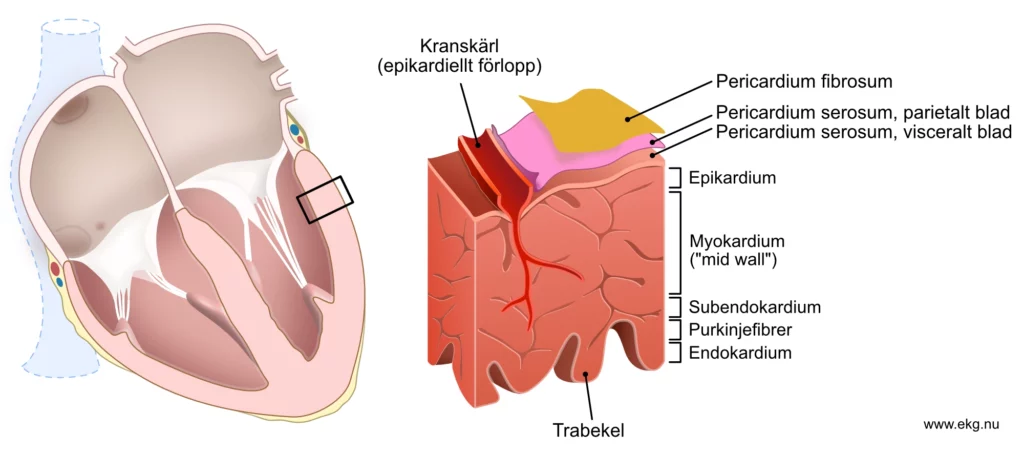
STEMI är ett kliniskt syndrom som kännetecknas av symtom på myokardiell ischemi (framför allt bröstsmärta) tillsammans med ST-höjningar och förhöjda troponiner. Som tidigare nämnt har nästan alla patienter som uppvisar kliniska tecken på myokardischemi (t ex bröstsmärta) och ST-höjningar också förhöjda troponinnivåer, vilket gör akut koronart syndrom med ST-höjning (STE-AKS) synonymt med STEMI. Som illustrerat i Figur 2 orsakas STEMI av en komplett trombos proximalt i kranskärlet. Detta leder till allvarlig ischemi i det myokardium som försörjs av kärlet och dess förgreningar. Ischemin är transmural, vilket innebär att den drabbar hela väggtjockleken, från endokardiet till epikardiet (Figur 3).
Video 1 och Video 2 visar koronarangigrafi innan och efter PCI (Todt et al).
Epidemiologi för ST-höjningsinfarkt (STEMI)
Incidens av STEMI
År 1990 utgjorde STEMI nästan 50% av alla akuta koronara syndrom (AKS). Sedan dess har incidensen minskat och de senaste åren har STEMI utgjort cirka 25-30% av alla hjärtinfarkter. Omvänt har andelen som drabbas av NSTEMI ökat, vilket sannolikt beror på att troponinanalyserna blivit mycket känsligare. Parallellt har andelen med instabil angina minskat, eftersom en allt större andel av dessa klassificeras som NSTEMI (Martin et al.).
Mortalitet i STEMI
Dödligheten i STEMI har också minskat dramatiskt under de senaste decennierna. Dödligheten på sjukhus är för närvarande 5% och 1-årsdödligheten är 7-15%. Omkring 70% av patienterna med STEMI är män. Kvinnor har en längre fördröjning från symtomdebut till första kontakt med sjukvården, och kvinnor har något lägre chans att erhålla evidensbaserade interventioner. Till viss del kan detta förklaras av att kvinnor, oftare än män, tenderar att uppvisa atypiska symtom (Smilowitz et al.). Ungefär var fjärde patient med STEMI har diabetes, vilket också medför en ökad risk för komplikationer (t ex hjärtsvikt) och död (både i akutskedet och på lång sikt). Äldre patienter och patienter med njursjukdom har också lägre chans att få evidensbaserade behandlingar, trots att det finns bevis för att sådana åtgärder gagnar dem.
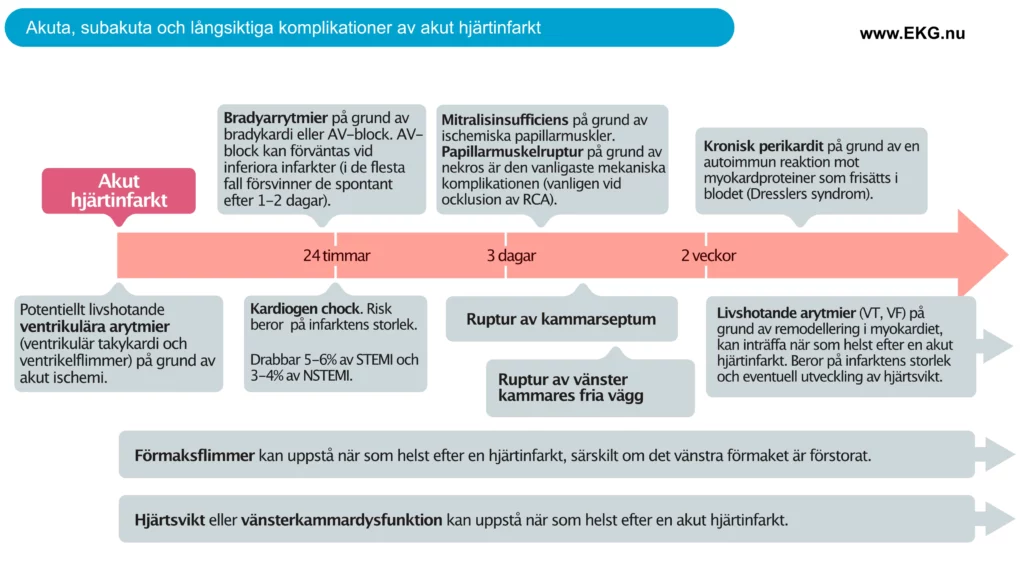
Akuta och långsiktiga komplikationer
Akut hjärtinfarkt, särskilt STEMI, kan leda till flera akuta och långsiktiga komplikationer. Livshotande arytmier som ventrikeltakykardi och ventrikelflimmer kan uppkomma när som helst efter att ocklusionen uppstått och risken är högst den första timman. Faktum är att dessa arytmier orsakar majoriteten av alla dödsfall vid hjärtinfarkt, oavsett typ av infarkt. Risken för allvarliga arytmier minskar avsevärt efter cirka 5-6 timmar. Dock kvarstår risken på sikt bland patienter som drabbas av stora infarkter och hjärtsvikt. I dessa fall uppstår en remodellering i myokardiet, och denna predisponerar för allvarliga ventrikulära arytmier.
Mekaniska komplikationer är mycket allvarliga. Den vanligaste är papillarmuskelruptur, som kan orsaka kardiogen chock. Rupturer i septum eller vänster kammares fria vägg är ovanliga och mortaliteten är mycket hög. Mekaniska komplikationer åtgärdas med kirurgi.
Papillarmuskelruptur
Papillarmuskelruptur drabbar cirka 1% av patienter med akut hjärtinfarkt. Den utvecklas vanligen inom 2 till 7 dagar efter infarkten. Den posteromediala papillarmuskeln drabbas cirka tio gånger oftare än den anterolaterala papillarmuskeln. Den posteromediala muskelns sårbarhet förklaras av att den hos de flesta individer bara erhåller blod från ett kärl (oftast PDA, som kommer från RCA). Anterolaterala papillarmuskeln har oftast blodförsörjning från både LAD och LCx, vilket ger redundans vid en eventuell ocklusion i ett av dessa kärl (Rich et al.). Patienter med papillarmuskelruptur uppvisar plötsligt insättande svår mitralisinsufficiens (MI), oftast med akut lungödem, hypotension och slutligen kardiogen chock. Ett nytt systoliskt blåsljud och klinisk försämring skall föra tankarna till papillarmuskelruptur. Tidigt kirurgiskt ingrepp är avgörande för prognosen.
EKG vid ST-höjningsinfarkt (STEMI)
EKG är nyckeln till att diagnostisera STEMI. EKG-kriterier för STEMI används dock inte vid förekomst av vänstergrenblock (LBBB) eller vänsterkammarhypertrofi (LVH) eftersom dessa tillstånd orsakar sekundära ST-T-förändringar som kan maskera eller simulera ischemiska ST-T-förändringar. ST-höjning mäts i J-punkten och höjningen måste vara signifikant i minst två anatomiskt angränsande avledningar. Med angränsande avses avledningar som är anatomiskt direkt sammanhängande. Exempelvis är avledningarna V3 och V4 angränsande, liksom V1 och V2. Däremot är V3 och V5 inte angränsande, eftersom avledning V4 är placerad mellan dessa.
J-punktshöjning ≥1 mm anses vara signifikant i alla avledningar förutom V2 och V3. Detta förklaras av att de flesta kvinnor och män normalt uppvisar viss ST-höjning i V2 och V3, varför en högre nivå krävs i dessa avledningar. Se Panel 1 för EKG-kriterier för STEMI.
Panel 1: EKG-kriterier för diagnos av akut STEMI
- Nya ST-höjningar i minst två anatomiskt sammanhängande avledningar:
- Män ≥40 år: ≥2 mm i V2-V3 och ≥1 mm i alla andra avledningar.
- Män ålder <40 år: ≥2,5 mm i V2-V3 och ≥1 mm i alla andra avledningar.
- Kvinnor (alla åldrar): ≥1,5 mm i V2-V3 och ≥1 mm i alla andra avledningar.
- Män och kvinnor V4R och V3R: ≥0,5 mm, med undantag för män <30 år för vilka kriteriet är ≥1 mm.
- Män och kvinnor V7-V9: ≥0,5 mm.
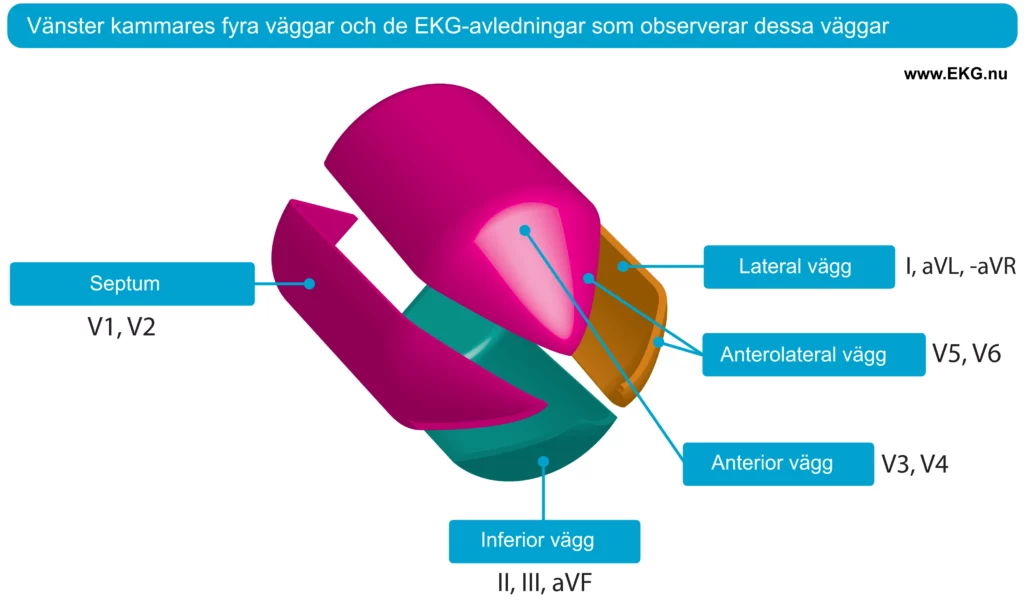
Vid STEMI avspeglar avledningar med ST-höjningar det ischemiska området. Exempelvis indikerar ST-höjningar i avledningarna V3 och V4 (anteriora bröstavledningarna) anterior ischemi, medan ST-höjningar i avledningarna aVF och II indikerar inferior ischemi. Figur 5 visar vänster kammares fyra väggar och de EKG-avledningar som återspeglar dessa områden.
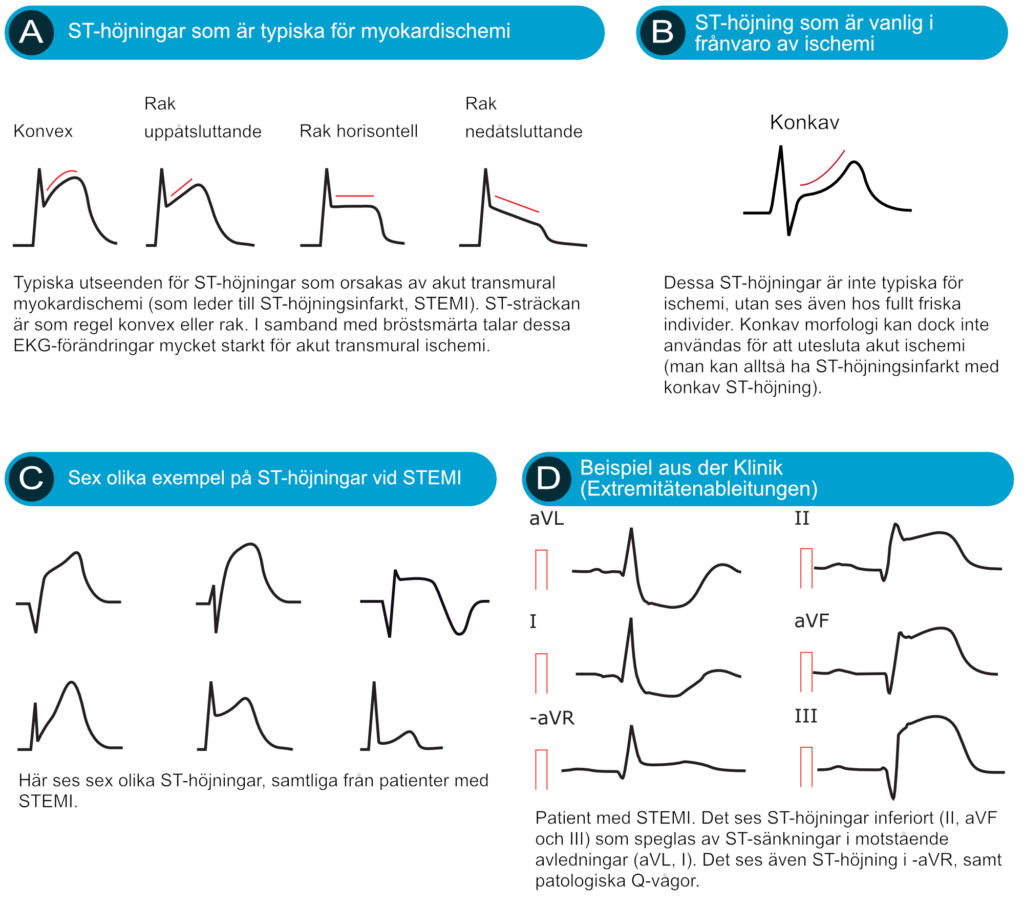
ST-höjningar med raka (horisontella, uppåtsluttande eller nedåtsluttande) eller konvexa ST-segment talar starkt för akut STEMI (Figur 6A). Konkava ST-höjningar är mindre vanliga vid STEMI. I Europeiska och Nordamerikanska riktlinjer noteras att konkava ST-höjningar talar emot, men utesluter inte, STEMI.
Andra orsaker till ST-höjningar på EKG
Beträffande differentialdiagnoser kan minst 16 andra tillstånd orsaka ST-höjningar. Dessa tillstånd har diskuterats i kapitlet ST-höjningar vid Ischemi och Differentialdiagnoser. Vissa av dessa tillstånd är godartade medan andra är potentiellt livshotande.
Panel 2. Differentialdiagnoser av ST-höjningar
- Manligt/kvinnligt mönster (”male pattern”)
- Tidig repolarisation (early repolarization syndrome)
- Vänsterkammarhypertrofi (LVH)
- Vänstergrenblock (LBBB)
- Perikardit (myokardit, perimyokardit)
- Hyperkalemi
- Brugada syndrom
- Lungemboli
- Aortadissektion
- Arytmogen högerkammar dysplasi (ARVD, ARVC)
- Pre-excitation (Wolff-Parkinson-White syndrom)
- Elkonvertering kan ge övergående ST-höjningar
- Takotsubo kardiomyopati
- Prinzmetals angina (variantangina, spasmangina)
- Hypotermi
- Hyperkalcemi
- Aneurysm i vänster kammare
Reciproka ST-sänkningar, T-vågsinversioner (negativa T-vågor) och patologiska Q-vågor vid STEMI
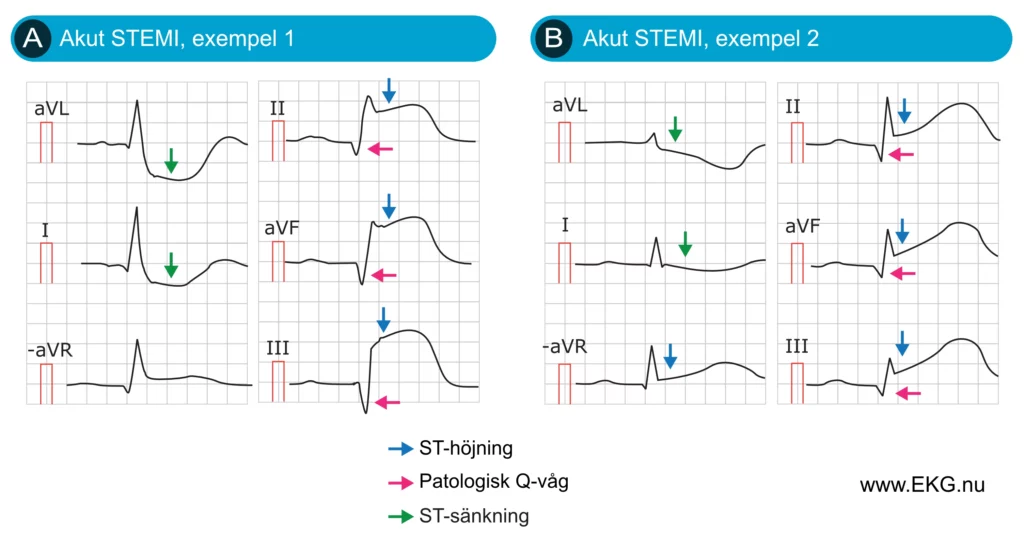
I de flesta fall ackompanjeras ST-höjningar vid STEMI av reciproka ST-sänkningar. Sådana ST-sänkningar är spegelbilder av ST-höjningarna och ses därför i avledningar som är i motsatt vinkel jämfört med de som visar ST-höjningar. Figur 7 visar två patienter med akut STEMI, med tydliga reciproka ST-sänkningar i båda fallen.
Hos patienter med STEMI normaliseras ST-höjningarna gradvis inom 15 timmar. ST-höjningar följs av T-vågsinversioner, som kan kvarstå i en månad eller längre. Patologiska Q-vågor kan uppträda om infarktområdet är stort (majoriteten av STEMI-patienter utvecklar sådana Q-vågor). Dessa Q-vågor är onormalt breda och djupa (≥30 ms duration) och uppkommer som tidigast efter 3 timmar. De indikerar att infarkten är utbredd. Infarkter som resulterar i patologiska Q-vågor kallas Q-vågsinfarkter.
Aborted myocardial infarction (avbruten infarkt)
I sällsynta fall kan tromben lysera (antingen spontant eller med hjälp av reperfusionsbehandling) innan infarktprocessen inleds. I sådana fall förblir troponinnivåer normala och tillståndet klassificeras som instabil angina eller avbruten hjärtinfarkt. Detta är dock ovanligt och i stort sett alla fall av STE-AKS utvecklar STEMI.
Särskilda situationer
EKG kan vara missvisande hos vissa patienter med akut transmural ischemi. Vissa patienter har andra störningar på EKG (t ex vänstergrenblock, hypertrofi, pacemakerrytm) som gör det svårt att upptäcka ischemiska EKG-förändringar. I andra fall kan en akut transmural ischemi föreligga i ett område som inte upptäcks av avledningarna i ett traditionellt 12-avlednings-EKG. Dessa situationer diskuteras nedan.
Vänstergrenblock (LBBB) och akut hjärtinfarkt
Vänstergrenblock (LBBB) föreligger om vänster skänkel är defekt, så att depolarisation (aktivering) av vänster kammare är beroende av impulser från höger kammare. Detta resulterar i onormal depolarisation och repolarisation av vänster kammare, vilket ger upphov till uttalade ST-T-förändringar, inklusive ST-höjningar (i avledning V1-V3), ST-sänkningar (avledning V4, V5, V6, aVL, I) och inverterade T-vågor (avledningar med ST-sänkningar). Dessa ST-T-förändringar illustreras i Figur 6. Observera att dessa förändringar normala och förväntade hos individer med vänstergrenblock.
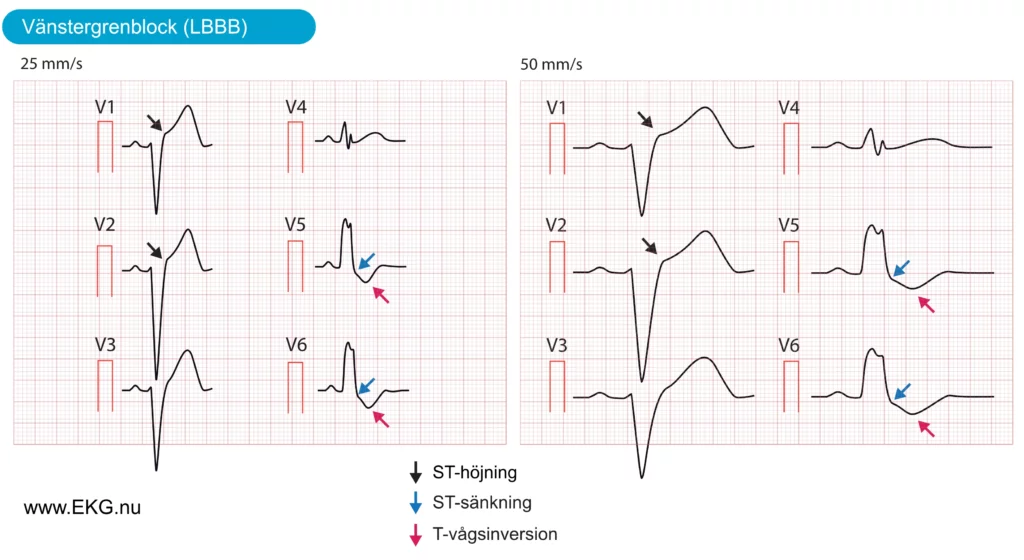
Det finns tre skäl till att LBBB försvårar bedömningen av patienter med misstänkt akut hjärtinfarkt:
- Vänstergrenblock (LBBB) kan efterlikna akut STEMI, eftersom LBBB ofta uppvisar liknande EKG-förändringar, inklusive ST-höjningar, ST-sänkningar och T-vågsinversioner. Detta leder ofta till förväxling mellan LBBB och akut STEMI.
- LBBB kan maskera (dölja) pågående ischemi: LBBB orsakar en uttalad elektrisk störning under de- och repolarisation. Detta förhindrar andra ST-T-förändringar (t ex de som uppstår till följd av ischemi) från att komma till uttryck på EKG. Därför döljs vanligtvis ischemiska ST-T-förändringar av LBBB. En patient med akut STEMI kan därför uppvisa ett normalt LBBB-mönster.
- LBBB kan orsakas av ischemi/infarkt: Det finns flera orsaker till LBBB, varav ischemi och infarkt är en av dessa. Därför kan en akut hjärtinfarkt orsaka LBBB som sedan maskerar de ischemiska ST-T-förändringarna på EKG.
Sammanfattningsvis kan vänstergrenblock (LBBB) uppstå till följd av, efterlikna eller dölja akut ischemi, vilket orsakar diagnostiska utmaningar. Detta föranledde att forskare genomförde randomiserade studier där patienter med misstänkt akut koronart syndrom och vänstergrenblock randomiserades till att genomgå akut fibrinolys (som på den tiden var gold standard för reperfusion) eller sedvanlig behandling (Wilner et al.). Resultaten visade att utfallet förbättrades när dessa patienter behandlades som akuta STEMI-fall, vilket blev klinisk praxis i flera decennier.
Under många år rekommenderades därför att patienter med symtom på myokardischemi och nytt (eller förmodat nytt) vänstergrenblock skulle behandlas som akut STEMI. Senare studier indikerade dock att detta förfarande resulterade i en oacceptabel hög andel onödiga koronarangiografier. Man har följaktligen reviderat rekommendationerna; nytt eller förmodat nytt vänstergrenblock är inte längre ekvivalent med akut STEMI (O’Gara et al.). Istället bör patienter med hög klinisk misstanke om pågående myokardischemi, oavsett EKG- eller biomarkörfynd, behandlas på samma sätt som patienter med klar STEMI. Detta gäller särskilt patienter med uttalade symtom trots behandling, är hemodynamiskt instabila eller utvecklar ihållande ventrikulära arytmier. På liknande sätt reviderades riktlinjerna från European Society of Cardiology (ESC) år 2023 med rekommendationen att patienter som uppvisar LBBB eller RBBB och tecken eller symtom som starkt indikerar pågående myokardischemi ska behandlas som patienter med definitiv STEMI, oavsett om grenblocket tidigare har dokumenterats (Byrne et al.).
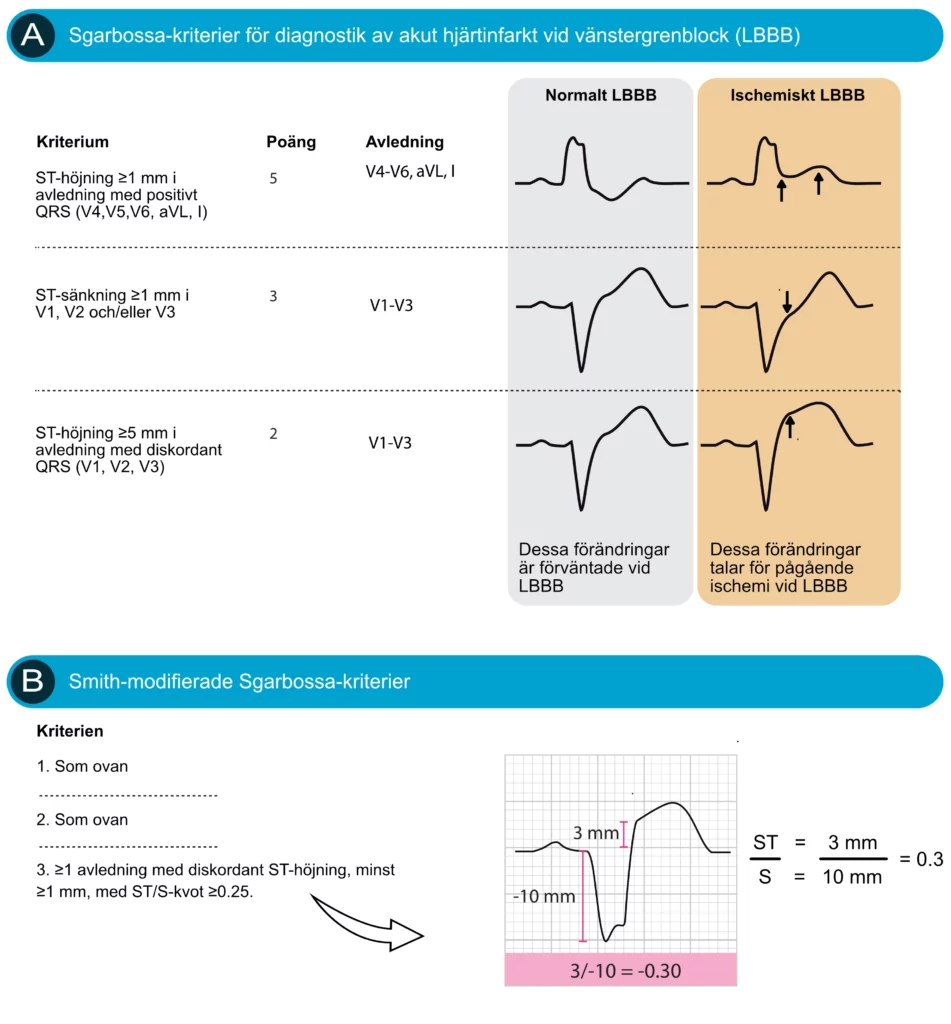
Sgarbossa-kriterier för diagnos av akut STEMI vid LBBB
Det är mycket svårt att identifiera kliniskt säkra kriterier för akut ischemi på EKG med vänstergrenblock. Forskningen på detta område har varit intensiv utan att några säkra kriterier har kunnat definieras (Tabas et al.). Bland de mest användbara och validerade kriterierna finns Sgarbossa-kriterierna (Neeland et al.). Dessa kriterier sammanfattas i Figur 7. För en omfattande diskussion hänvisas till kapitlet Diagnostik av Hjärtinfarkt vid Vänstergrenblock (LBBB).
STEMI utan ST-höjningar på EKG
Det finns situationer då akut transmural ischemi inte orsakar ST-höjningar på EKG. Dessa situationer inkluderar:
- Transmural ischemi i posterolaterala väggen: Detta kallas posterior, posterolateral eller inferobasal STEMI. På EKG föreligger ST-sänkningar i avledningarna V1–V3 (ibland även V4). Dessa sänkningar är reciproka ST-sänkningar, vilka speglar bakre ST-höjningar. För att skönja ST-höjningarna måste kompletterande avledningar V7, V8 och V9 anslutas.
- Laterala infarkter pga ocklusion i LCx: LCx försörjer vänster kammares laterala vägg. Fullständiga ocklusioner i LCx kan ibland inträffa utan att ST-höjningar på EKG.
- Högerkammarinfarkt: Ingen avledning i 12-avlednings-EKG är tillräckligt bra för att upptäcka högerkammarinfarkt. Ibland kan ST-höjningar observeras i V1 och, mer sällan, V2. För att upptäcka ST-höjningar orsakade av högerkammarinfarkt skall högersidiga avledningar, dvs V3R och V4R, anslutas.
Icke-signifikanta ST-höjningar
Transmural ischemi kan resultera i icke-signifikanta ST-höjningar i en eller flera avledningar, alternativt signifikanta ST-höjningar i endast en avledning. I sådana fall är formella kriterier för STEMI inte uppfyllda, men patienten kan ändå utveckla STEMI. Det är avgörande att bibehålla en hög misstanke om STEMI hos patienter med bröstsmärta, även om ST-höjningarna är under den diagnostiska gränsen. Det aterotrombotiska förloppet vid STEMI är dynamiskt, vilket innebär att trombosens storlek, och därmed graden av flödeshinder, kan variera minut för minut. Det är viktigt att upprepa EKG-registreringen med regelbundna intervall (t ex var 5:e minut, eller vid tilltagande bröstsmärtor). Denna strategi ökar sannolikheten att upptäcka dynamiska förändringar som tyder på STEMI.
Hyperakuta T-vågor
Kraftiga T-vågor förekommer vid flera tillstånd, exempelvis hyperkalemi och tidig repolarisation. Transmural ischemi kan alstra hyperakuta T-vågor, vilka är höga, breda och symmetriska. Hyperakuta T-vågor uppträder inom sekunder efter en koronaroccklusion och representerar den tidigaste EKG-förändringen vid STEMI. De försvinner vanligtvis inom några minuter och övergår till ST-höjningar allteftersom ischemin fortskrider. Även om hyperakuta T-vågor är snabbt övergående påträffas de inte sällan hos patienter med dynamiska EKG-förändringar, särskilt i tidigt skede (Figur 8).

Normalisering av EKG-förändringar vid STEMI
Hos patienter med STEMI normaliseras ST-T-förändringarna inom dagar eller veckor. QRS-förändringar är oftast permanenta, särskilt Q-vågor. Reperfusion (PCI, fibrinolys) påskyndar hastigheten med vilken EKG normaliseras hos patienter med STEMI.
Riskstratifiering i det akuta skedet
Tidig och korrekt riskbedömning kan förbättra överlevnaden vid STEMI. Flera validerade riskmodeller har utvecklats för att underlätta riskstratifiering. Dessa modeller inkluderar information om tidigare sjukhistoria, EKG, initiala symtom (framför allt hemodynamiskt status) och hjärttroponiner. De bäst validerade modellerna är TIMI Score (Morrow et al.) och GRACE Score (Keith et al.). Dessa skiljer sig åt avseende vilken typ av risk som uppskattas (korttids-, långtidsrisk, hjärtinfarkt, död). TIMI Score är enklast att använda, medan GRACE Score har visat högst precision.
Behandling av ST-höjningsinfarkt (STEMI)
Ocklusion i ett kranskärl leder omedelbart till ischemi i myokardiet som försörjs av kärlet och dess grenar. Myokardium tolererar ischemi i cirka 30 minuter innan cellerna dör (hjärtinfarkt). Som tidigare diskuterats orsakas STEMI av en komplett ocklusion i ett kranskärl, vilket leder till omfattande ischemi och hög risk för livshotande kammararytmier (ventrikeltakykardi, ventrikelflimmer). Risken för död är högst under den första timmen efter symtomdebut, vilket beror på den höga risken för arytmier under denna fas. Den absoluta merparten av alla dödsfall det första dygnet orsakas av ventrikelflimmer. Dödsfall på grund av hjärtsvikt och kardiogen chock är betydligt ovanligare.
Den pre-hospitala fasen
På grund av risken för ventrikulära arytmier och progredierande myokardnekros är snabb bedömning och åtgärd avgörande vid STEMI. Eftersom majoriteten av dödsfallen inträffar utanför sjukhus, oftast under den första timmen, rekommenderar amerikanska och europeiska riktlinjer att individer med bröstsmärta skall tillkalla ambulans. Ambulanspersonal skall vara utbildad i avancerad hjärt-lungräddning och erfarna i det tidiga omhändertagande av patienter med STEMI.
Den pre-hospitala vårdkedjan inleds på larmcentralen. Larmoperatören använder standardiserade triageprotokoll för patienter med bröstsmärta och säkerställer att ambulans anländer snabbt. Ambulansen kan omedelbart påbörja diagnostik, etablera intravenösa infarter, bedöma vitala funktioner och hanteraventrikulära arytmier och hemodynamisk instabilitet. Administrering av acetylsalicylsyra, nitroglycerin, morfin och syrgas görs rutinmässigt i den pre-hospitala miljön. Ambulansen kan rekvirera 12-avlednings-EKG, tolka EKG och skicka registreringen till sjukhusets hjärtavdelning för ytterligare bedömning. I Sverige är det nästan uteslutande HIA-avdelningar som ansvarar för bedömning av pre-hospitala EKG där STEMI misstänkts. Vid behov kan ambulansen även initiera reperfusion (fibrinolys) pre-hospitalt, vilket är aktuellt i glesbygder där PCI inte kan utföras inom 120 minuter.
Betydelsen av att minimera den pre-hospitala fördröjningen vid STEMI framgår av flera studier. Varje timme fördröjning pre-hospitalt (vilket inbegriper patientens egen fördröjning av söka vård) ökar mortaliteten med 10%. På liknande sätt ökar risken för att utveckla hjärtsvikt (till följd av STEMI) med 10% per 1 timme fördröjd behandling (Terkelsen et al.). Optimering av den pre-hospitala vårdkedjan kan därför minska tiden till intervention och därigenom reducera morbiditet och mortalitet.
Akutmottagningen
Förekomst av signifikanta ST-höjningar hos patienter med bröstsmärtor (eller andra symtom tydande på myokardischemi) är tillräcklig för att diagnostisera STE-AKS. Alla interventioner, inklusive reperfusion, kan utföras innan svar på troponiner är tillgängliga. Det är inte acceptabelt att invänta svar på troponinanalyser vid misstanke om STE-AKS. När diagnosen har bekräftats måste patienten övervakas kontinuerligt avseende hjärtrytm, blodtryck, andning, medvetandegrad, symtom och allmäntillstånd. En defibrillator skall vara redo, och intravenösa infarter skall etableras. De viktigaste differentialdiagnoserna är aortadissektion och lungemboli, varav förstnämnda utgör kontraindikation för administrering av blodförtunnande läkemedel.
Eftersom STE-AKS är ett kliniskt syndrom och troponinsvar inte är nödvändiga för att initiera behandling, kan antiischemisk och antitrombotisk medicinering administreras omedelbart, förutsatt att det inte föreligger kontraindikationer. I vissa fall (se nedan) kan även reperfusion administreras utan dröjsmål.
Den kliniska undersökningen inkluderar vitala parametrar (medvetandegrad, hjärtfrekvens och rytm, syrgasmättnad, blodtryck, andningsfrekvens), tecken på hjärtsvikt och lungödem samt blåsljud (mitralisinsufficiens, ventrikelseptumdefekt). En snabb bedömning av blödningsrisken bör också göras.
Patienter med tydliga symtom på myokardischemi som föregår ett plötsligt hjärtstopp bör transporteras direkt till PCI-lab om cirkulationen återkommer. Indikationerna för PCI efter hjärtstopp (förutsatt att cirkulation återkommer) är som följer:
- ST-höjningar på EKG.
- Återkommande ventrikulära arytmier tydande på akut ischemi.
- Tydliga ischemiska symtom innan hjärtstopp
Läkemedel och reperfusion vid akut ST-höjningsinfarkt (STEMI)
Syrgasbehandling
Syrgas ska administreras om syremättnaden är <90%. Det finns dock ingen evidens för att syrgasbehandling påverkar överlevnaden vid STEMI.
Studier har inte kunnat påvisa någon effekt av syrgasbehandling hos patienter med normala syrgasnivåer. Randomiserade kontrollerade studier som jämfört syrgas med rumsluft visade ingen effekt av syrgas till patienter med normal syrgasmättnad (>90%). Syrgas skall därför endast ges till patienter med syrgasmättnad <90%. Syrgas är också lämpligt för patienter med lungödem, hjärtsvikt och mekaniska komplikationer av akut STEMI (Hofmann et al.).
Analgetika
Morfin
Morfin (morfinsulfat) administreras till alla patienter med akut STEMI i doser om 2–5 mg intravenöst, och dosen kan upprepas var 5:e till 30:e minut vid behov. Försiktighet bör iakttas hos patienter med hypotension.
Smärta aktiverar det sympatiska nervsystemet, vilket leder till perifer vasokonstriktion, ökad kontraktilitet (positiv inotrop effekt) och högre hjärtfrekvens (positiv kronotrop effekt). Detta kan följaktligen öka hjärtats belastning och potentiellt förvärra ischemin, vilket är skadligt vid STEMI. Därför är adekvat smärtlindring en central del av behandlingen. Morfin är förstahandsvalet eftersom det lindrar smärta och ångest, samt orsakar venös dilatation, vilket minskar preload och därmed avlastar vänster kammare.
Dosering och försiktighetsåtgärder
Dosen morfin beror på smärtans intensitet, patientens ålder, kroppsmassindex (BMI) och cirkulatorisk status. Hos patienter med hypotension används reducerade doser eftersom morfin kan orsaka ytterligare vasodilatation.
Biverkningar
Vid överdos av morfin kan naloxon (0,1 mg intravenöst) administreras och upprepas var 10:e minut vid behov. Morfininducerad bradykardi kan behandlas med atropin, med en startdos på 0,5 mg intravenöst, som kan upprepas vid behov. Om smärtan kvarstår trots upprepad administrering av morfin bör differentialdiagnoser, såsom aortadissektion, övervägas.
Kontraindicerade analgetika
NSAID (icke-steroida antiinflammatoriska läkemedel) och selektiva cyklooxygenas II-hämmare (COX-2-hämmare) är kontraindicerade vid akut STEMI, eftersom de är associerade med ökad morbiditet och mortalitet.
Övriga analgetika
Nitrater och beta-blockerare har också analgetiska effekter. Även om morfin och beta-blockerare kan förstärka varandras negativa hemodynamiska effekter, erbjuder beta-blockerare antiarytmiska fördelar vid ventrikulära arytmier.
Nitrater (nitroglycerin)
Indikationer och användning
Nitrater administreras till majoriteten av patienter med STEMI. Även om de inte påverkar prognosen, ger de symtomlindring. Sublingualt nitroglycerin (0,4 mg, kan upprepas två gånger med 5 minuters intervall) kan ges för att lindra ischemisk smärta. Om besvären inte avtar kan intravenöst nitroglycerin övervägas, särskilt hos patienter med hjärtsvikt eller okontrollerad hypertoni.
Nitrater verkar genom att inducera vasodilatation via relaxering av glatt muskulatur i artärer och vener. Vasodilatationen minskar det venösa återflödet till hjärtat, vilket sänker hjärtats preload och därmed belastningen på myokardiet. Detta leder till minskat syrebehov i myokardiet och symtomlindring vid ischemi och lungödem. De flesta patienter med STEMI bör erbjudas nitrater som en del av symtomlindrande behandling.
Dosering
En initial dos på 0,4 mg nitroglycerin (sublingualt eller tablett) ges och kan upprepas tre gånger med 5 minuters intervall. Om effekten är otillräcklig, exempelvis vid svår angina eller tecken på hjärtsvikt, kan en infusion övervägas. En intravenös infusion kan initieras med 5 μg/min och titreras upp var 5:e minut till 10–20 μg/min. Doseringen justeras tills symtomen lindras eller en maximal dos på 200–300 μg/min uppnås.
Kontraindikationer och försiktighet
Nitrater ska inte ges till patienter med hypotension, misstänkt högerkammarinfarkt, uttalad aortastenos, hypertrof obstruktiv kardiomyopati eller lungemboli. Försiktighet bör iakttas om blodtrycket sjunker mer än 30 mmHg från utgångsvärdet. Vid administrering till hypotensiva patienter eller patienter med misstänkt högerkammarinfarkt kan nitrater förvärra hemodynamisk instabilitet.
Beta-blockerare vid akut STEMI
- Ingen generell nytta av beta-blockerare: Det finns inga bevis för att rutinmässig användning av beta-blockerare efter STEMI minskar sjuklighet eller dödlighet hos patienter utan vänsterkammardysfunktion.
- Patienter med vänsterkammardysfunktion (HFrEF): Beta-blockerare har visat sig minska sjuklighet och dödlighet hos patienter med akut hjärtinfarkt och hjärtsvikt med reducerad ejektionsfraktion (HFrEF). I denna grupp är användning av beta-blockerare starkt evidensbaserad.
- Rekommendationer från riktlinjer: 2023 års riktlinjer från ESC föreslår att intravenösa betablockerare, helst metoprolol, bör övervägas vid ankomst för patienter som genomgår primär PCI, om patienten inte visar tecken på akut hjärtsvikt, har ett systoliskt blodtryck >120 mmHg och inga andra kontraindikationer föreligger (Klass IIa, Evidensnivå A).
Evidens för betablockerare
Innan reperfusionseran (dvs innan PCI och fibrinolys blev gängse behandling) visade beta-blockerare gynnsamma effekter, som minskad infarktstorlek och förbättrad överlevnad (Braunwald et al.). Dessa studier genomfördes dock under en tidsperiod då infarkter generellt var större, jämfört med dagens hjärtinfarkter (Hoedmaker et al.). På senare tid har effekten av beta-blockerare ifrågasatts för patienter som drabbats av hjärtinfarkt utan efterföljande hjärtsvikt. En metaanalys (Bangalore et al.) fann ingen nytta av beta-blockerare i denna population. Nyligen visade även REDUCE-AMI att behandling med beta-blockerare vid akut hjärtinfarkt med bevarad ejektionsfraktion (≥50 %) inte minskade risken för död eller ny hjärtinfarkt jämfört (Yndigegn et al.).
Fysiologiska effekter av betablockerare
Betablockerare har negativa inotropa och kronotropa effekter, vilket leder till lägre hjärtfrekvens (förlängd diastole), minskad hjärtminutvolym och lägre blodtryck. Dessa effekter minskar myokardiets belastning och syreförbrukning. Förlängningen av diastole förbättrar även myokardiell perfusion, då koronarflödet sker främst under diastole. Betablockerare har också en antiarytmisk effekt genom att blockera sympatikusstimulering.
Dosering:
- Intravenöst metoprolol: 5 mg, som kan upprepas upp till tre gånger med 5–10 minuters intervall, under kontinuerlig övervakning av hjärtfrekvens och blodtryck.
- Oralt metoprolol: 25 mg var sjätte timme, titreras till maximalt tolererad dos upp till 200 mg dagligen.
Kontraindikationer för betablockerare
- Akut hjärtsvikt: Betablockerare bör undvikas under den akuta fasen men kan initieras tidigt när hjärtsvikten stabiliserats.
- AV-block: Första gradens AV-block kräver uppföljande EKG efter administrering av betablockerare. Andra och tredje gradens AV-block (utan pacemaker) är kontraindikationer.
- KOL: Patienter med kroniskt obstruktiv lungsjukdom (KOL) bör få beta-1-selektiva betablockerare (t.ex. bisoprolol, metoprolol).
Trots tidigare frikostig användning av betablockerare är det nuvarande bevisunderlaget begränsat till patienter med hjärtsvikt och reducerad ejektionsfraktion (EF).
Trombocythämmare
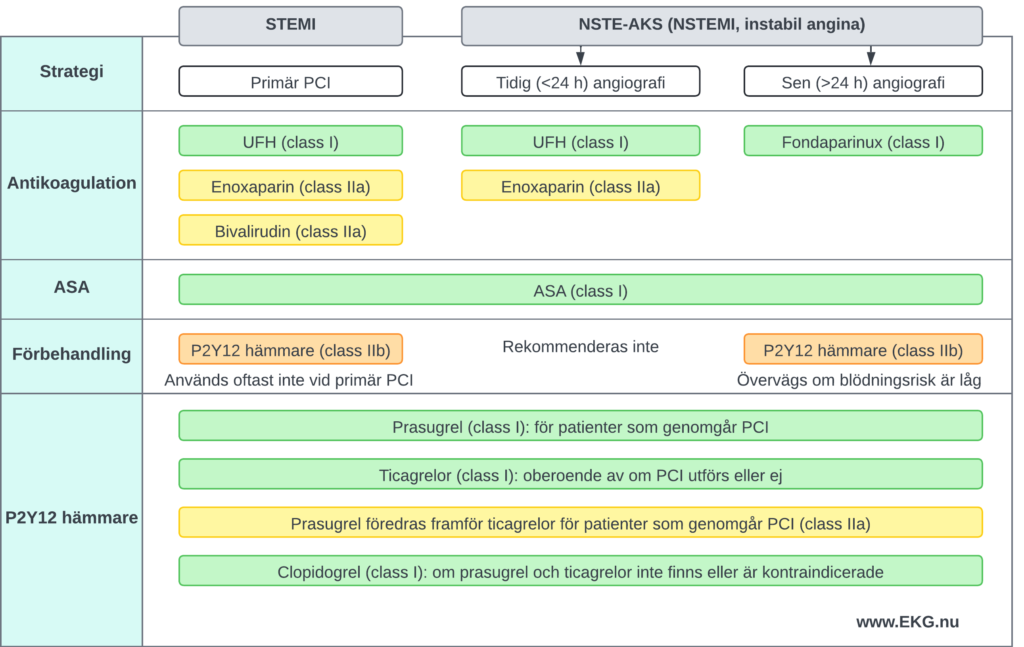
Figur 9. Översikt över antitrombotisk behandling vid STEMI och NSTE-ACS (NSTEMI och instabil angina).
Acetylsalicylsyra (ASA)
- Laddningsdos: 160–320 mg peroralt omedelbart vid diagnos av STE-AKS. Ges även innan primär PCI.
- Underhållsdos: 75–80 mg dagligen, ges på obestämd tid.
Dosering och administration
Alla patienter bör omedelbart få en oral laddningsdos av acetylsalicylsyra (320 mg). Acetylsalicylsyra kan administreras pre-hsopitalt och innan primär PCI. Behandlingen fortsätter därefter tills vidare, med en underhållsdos på 75–80 mg dagligen.
Patienter som inte kan svälja acetylsalicylsyra kan istället få:
- Suppositorium ASA: 300 mg.
- Intravenös ASA: 80–150 mg.
Evidens för acetylsalicylsyra (ASA)
Tidiga studier har visat att aspirin har en stor effekt vid STEMI, med en minskning av 30-dagars mortalitet med 23% (ISIS-1, ISIS-2). En laddningsdos på 160–320 mg rekommenderas för alla patienter med akut STEMI. För patienter med överkänslighet mot aspirin, vilket är sällsynt, kan clopidogrel användas som ett alternativ.
Dosjustering av ASA
Aspirin kräver ingen dosjustering för patienter med kronisk njursjukdom (njursvikt).
Dual Antiplatelet Therapy (DAPT)
Dubbel trombocythämmande behandling (DAPT) med P2Y12-receptorhämmare
- Dubbel trombocythämmande behandling (DAPT) rekommenderas för alla patienter som genomgår PCI. Dock kvarstår oklarhet beträffande den optimala tidpunkten för initiering av DAPT, särskilt vad gäller tillägg av P2Y12-hämmare till acetylsalicylsyra.
- Enligt riktlinjer från ESC kan förbehandling med P2Y12-hämmare (dvs administrering av P2Y12-hämmare direkt innan PCI) övervägas för patienter som genomgår primär (dvs omedelbar) PCI. Riktlinjerna nämner också att P2Y12-hämmaren alternativt kan ges i samband med PCI, när angiografin har genomförts och behandlingsbeslut kan fattas. I Sverige används oftast inte förbehandling; administrering av P2Y12-hämmaren görs på PCI-lab i samband med PCI. Således kan man undvika att administrera en P2Y12-hämmare till en patient som visar sig behöva CABG.
- Klopidogrel är den minst effektiva P2Y12-receptorhämmaren och bör endast användas när prasugrel eller tikagrelor är kontraindicerade, otillgängliga eller om det föreligger en hög blödningsrisk. Klopidogrel kan också vara lämpligt hos äldre patienter.
- Prasugrel bör föredras framför tikagrelor för patienter som genomgår PCI. ISAR-REACT 5-studien visade att prasugrel var överlägset jämfört med tikagrelor (Schupke et al.).
Optimal trombocythämningen kräver en kombination av acetylsalicylsyra och en P2Y12-receptorhämmare (tikagrelor, prasugrel eller klopidogrel), vilket benämns dubbel trombocythämmande behandling (DAPT). En individuell bedömning av blödningsrisken är nödvändig, och DAPT bör undvikas vid hög blödningsrisk. Behandlingen fortsätter oftast i 12 månader, med starkare indikation för patienter som genomgår PCI med stentplacering (oavsett typ av stent).
Förbehandling med P2Y12-hämmare
Förbehandling med en P2Y12-hämmare innebär administrering av en laddningsdos före koronarangiografin, vilket innebär administrering i ambulansen, akutmottagningen eller på HIA (Niezgoda et al.). Syftet med detta är att uppnå snabb trombocythämning. Dock visar forskningen att förbehandling inte ger signifikanta kardiovaskulära fördelar och kan öka risken för större blödningar. Dessutom kan det komplicera akuta kirurgiska ingrepp på grund av en ökad blödningsrisk (Dawson et al.). Nuvarande riktlinjer ger inga tydliga rekommendationer kring optimal användning av förbehandling. I klinisk praxis (2025) ges P2Y12-hämmare först efter att koronarangiografi genomförts och beslut har fattats om PCI (som kräver P2Y12-hämmare) eller kirurgi (P2Y12-hämmare avstås). Förbehandling rekommenderas dock när en tidig invasiv strategi inte planeras, förutsatt att patienten har låg blödningsrisk.
Klopidogrel (Plavix)
- Tillägg av klopidogrel till acetylsalicylsyra minskar mortaliteten med ytterligare 13 %. En laddningsdos på 600 mg följt av en underhållsdos på 75 mg dagligen rekommenderas.
- Klopidogrel medför en mindre ökning av blödningsrisken jämfört med prasugrel och tikagrelor.
- Klopidogrel kräver ingen dosjustering hos patienter med kronisk njursjukdom (CKD).
Prasugrel (Efient)
- Prasugrel är en mer potent trombocythämmare jämfört med klopidogrel och har visat sig ge större minskningar av kardiovaskulär dödlighet, icke-fatala akuta hjärtinfarkter och stroke (Wiviott et al.).
- Randomiserade kliniska studier indikerar att prasugrel är särskilt effektiv hos patienter med anterior STEMI.
- Rekommenderad dosering är en laddningsdos på 60 mg följt av en underhållsdos på 10 mg dagligen.
- Prasugrel är kontraindicerat hos patienter med tidigare stroke, TIA eller leverinsufficiens och bör användas med försiktighet hos patienter över 75 år eller med kroppsvikt under 60 kg på grund av ökad blödningsrisk.
Dosjusteringar och kontraindikationer
- Patienter med kroppsvikt <60 kg: underhållsdos 5 mg dagligen.
- Patienter ≥75 år: underhållsdos 5 mg dagligen.
- Ingen specifik dosjustering krävs vid njursvikt.
- Tidigare stroke, TIA eller leversvikt är kontraindikationer.
Tikagrelor (Brilique)
- Tikagrelor (laddningsdos 180 mg, underhållsdos 90 mg två gånger dagligen) är mer effektiv än klopidogrel och minskar kardiovaskulär dödlighet, icke-fatala hjärtinfarkter och stroke. PLATO-studien visade att tikagrelor orsakade fler allvarliga blödningar jämfört med klopidogrel, men de totala fördelarna ansågs överväga riskerna (Wallentin et al.).
- Patienter rapporterar ofta dyspné och ibland bradykardi under den första veckan av behandling med tikagrelor. Dessa biverkningar är godartade och vanligtvis övergående.
- Tikagrelor är kontraindicerat hos patienter med tidigare cerebrala blödningar eller leverinsufficiens (klopidogrel rekommenderas i dessa fall).
- Tikagrelor kräver ingen dosjustering hos patienter med CKD.
Antikoagulantia
- Ofraktionerat heparin (UFH) är förstahandsval och bör administreras till alla patienter med STEMI som genomgår primär PCI (klass I-rekommendation).
- Alternativa antikoagulantia (enoxaparin och bivalirudin) används hos patienter som genomgår primär PCI om UFH inte är tillgängligt.
Lågmolekylärt heparin (enoxaparin) och ofraktionerat heparin (UFH)
Lågmolekylärt heparin (enoxaparin) och ofraktionerat heparin (UFH) minskar mortaliteten hos patienter med STEMI. UFH föredras framför enoxaparin. Den rekommenderade laddningsdosen för UFH är 70–100 U/kg och administreras som en bolusdos. Om patienten även behandlas med GP IIb/IIIa-antagonister reduceras UFH-dosen till 50–60 U/kg.
Bivalirudin
Bivalirudin jämfördes med en kombination av UFH och GP IIb/IIIa-antagonister i HORIZONS-AMI-studien. Resultaten visade att bivalirudin orsakade färre blödningar och lägre mortalitet. Därför föredras bivalirudin framför kombinationen UFH+GP IIb/IIIa-antagonister hos patienter som genomgår primär PCI. Bivalirudin är också förstahandsval hos patienter med heparininducerad trombocytopeni (HIT) samt vid hög blödningsrisk.
Fondaparinux
Fondaparinux utvärderades i OASIS-6-studien, men visade inga gynnsamma effekter hos patienter som genomgick primär PCI. Tvärtom var fondaparinux associerat med en ökad risk för stenttrombos.
Glykoprotein (GP) IIb/IIIa-receptorantagonister
- GP IIb/IIIa-antagonister kan övervägas under PCI om proceduren inte är framgångsrik (långsam eller utebliven reperfusion) eller om angiografi visar massiv trombos eller trombosrelaterade komplikationer.
- GP IIb/IIIa-antagonister kan användas tillsammans med ofraktionerat heparin (som då dosreduceras), förutsatt att det inte föreligger kontraindikationer.
- GP IIb/IIIa-antagonister kan administreras under transport till hög-risk-patienter som ska genomgå primär PCI.
Dessa läkemedel (abciximab, tirofiban, eptifibatid, elinogrel) blockerar GP IIb/IIIa-receptorn, som finns på trombocyternas membran och förbinder trombocyter med fibrinogen och von Willebrands faktor. Denna läkemedelsklass utgör den mest potenta trombocythämmande behandlingen som finns tillgänglig. Tillägg av dessa medel ger dock liten nytta och verkar vara förbehållet vissa patientsubgrupper.
GP IIb/IIIa-hämmare används oftast under PCI vid uppkomst av komplikationer och är särskilt användbara i följande situationer:
- Långsamt koronart flöde (slow-reflow) efter PCI
- Uteblivet koronart flöde (no-reflow) efter PCI
- Omfattande trombos
Långsiktig antitrombotisk behandling hos patienter med STEMI
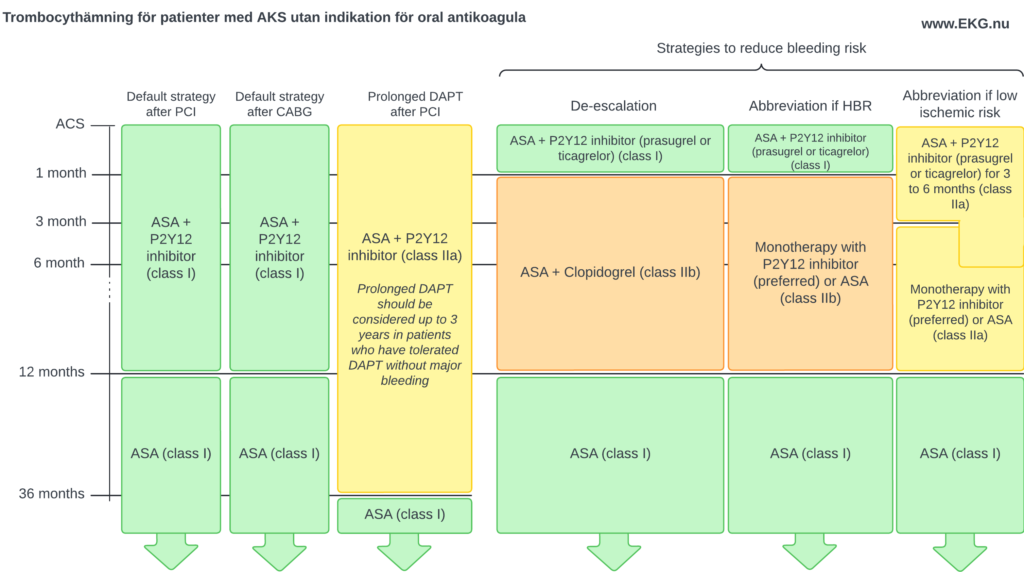
Patienter utan indikation för oral antikoagulation
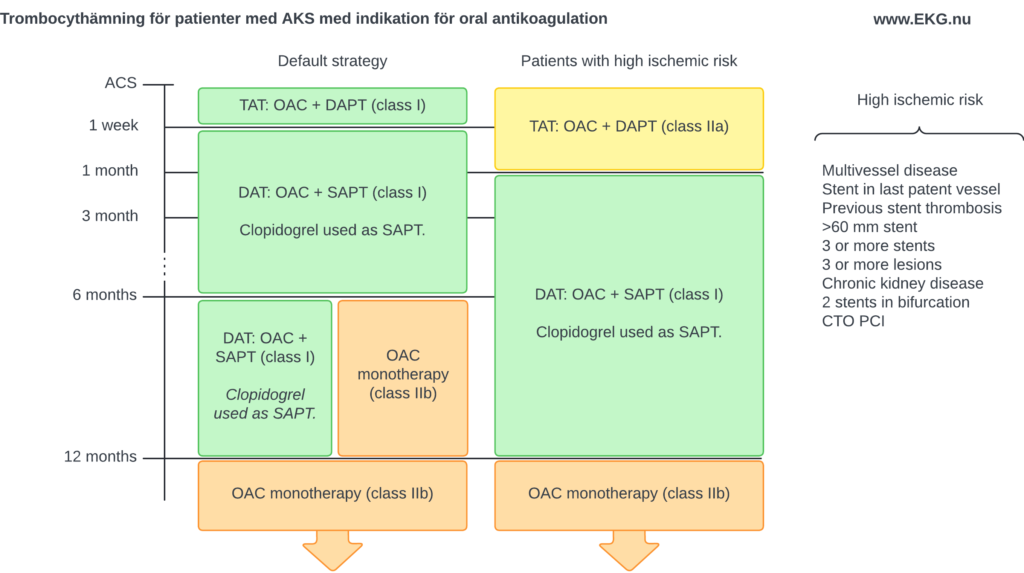
Figur 10 visar strategier för trombocythämning för patienter utan indikation för oral antikoagulantia.
Patienter med indikation för oral antikoagulation
Figur 11 visar strategier för trombocythämning för patienter med indikation för oral antikoagulantia (t ex patienter med förmaksflimmer som behandlas med orala antikoagulantia).
Reperfusion vid akut STEMI: PCI och fibrinolys
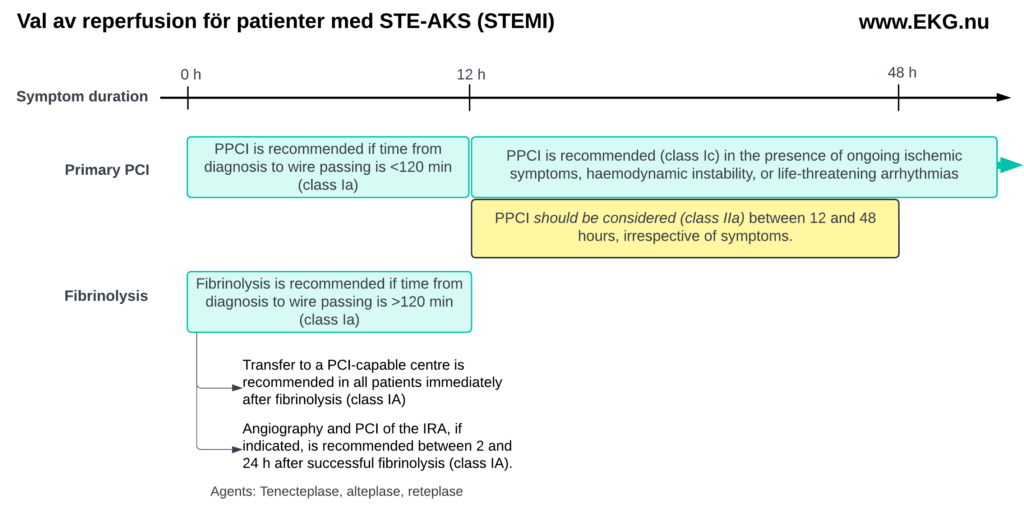
Reperfusion uppnås genom PCI eller intravenös fibrinolys. Lyckad reperfusion återställer blodflödet till det ischemiska området och avbryter infarktförloppet. PCI är överlägset fibrinolys om det kan utföras tidigt (inom 120 minuter).
- Primär PCI är den rekommenderade strategin för reperfusion (klass Ia) hos patienter med STEMI om tiden från diagnos till ledarpassage är <120 minuter.
- Om symtom pågått i mer än 12 timmar, rekommenderas primär PCI (klass Ic) hos patienter med pågående ischemiska symtom, hemodynamisk instabilitet eller livshotande arytmier.
- För patienter som söker vård 12–48 timmar efter symtomdebut bör PCI övervägas (klass IIa), även vid avsaknad av symtom.
- Om tiden från diagnos till PCI överstiger 120 minuter rekommenderas fibrinolys som initial reperfusionsstrategi (klass Ia). Efter fibrinolys rekommenderas överföring till ett PCI-center för alla patienter, oavsett utfall av fibrinolysen (klass Ia). Angiografi och PCI av det infarktrelaterade kärlet bör utföras 2–24 timmar efter lyckad fibrinolys (klass Ia).

Percutan koronar intervention (PCI)
PCI är överlägset fibrinolys. Reperfusionen är säkrare och risken för re-ocklusion är betydligt mindre. PCI är dessutom mindre beroende av symtomduration, medan effekten av fibrinolys är tidskänslig eftersom trombosen gradvis organiseras och blir mindre känslig för fibrinolys.
Handläggning av flerkärlssjukdom hos patienter med STEMI som genomgår PCI
- Komplett revaskularisering rekommenderas under det initiala ingreppet eller inom 45 dagar (klass I-rekommendation).
- Behandlingen av icke-infarktrelaterade kärl (non-IRA) bör baseras på angiografiska fynd (imaging och flödesreserver behöver inte användas).
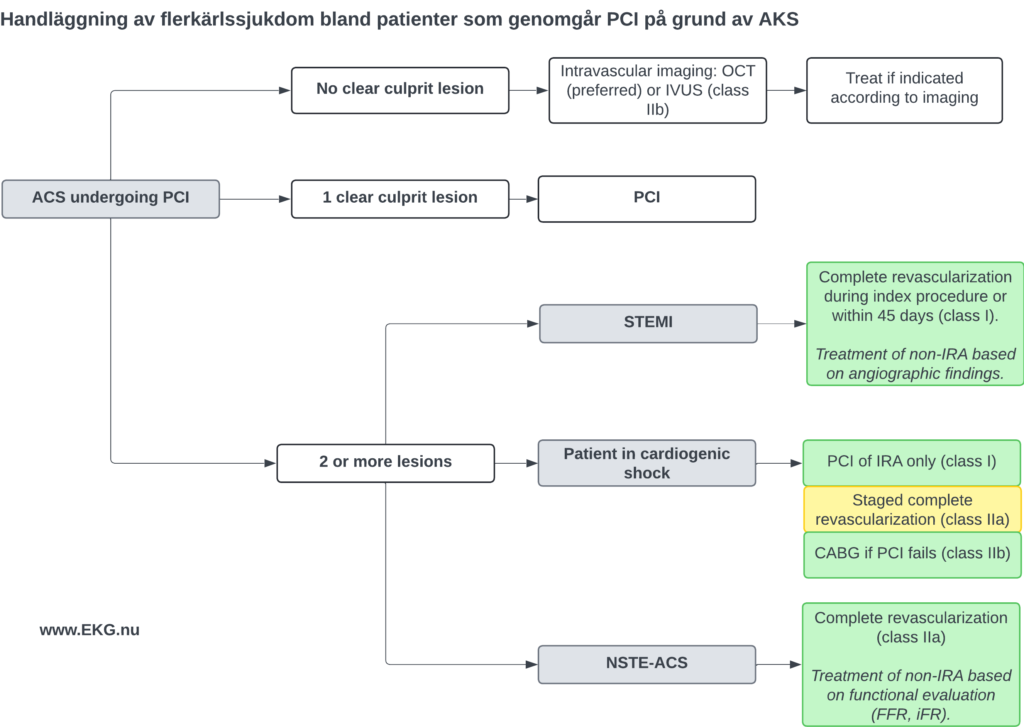
Patienter med kardiogen chock
- Initial behandling inkluderar enbart PCI av det infarktrelaterade kärlet (IRA; klass I-rekommendation).
- Staged komplett revaskularisering kan utföras därefter (klass IIa-rekommendation).
- Bypasskirurgi (CABG) kan övervägas om PCI misslyckas (klass IIb-rekommendation).
Fibrinolys
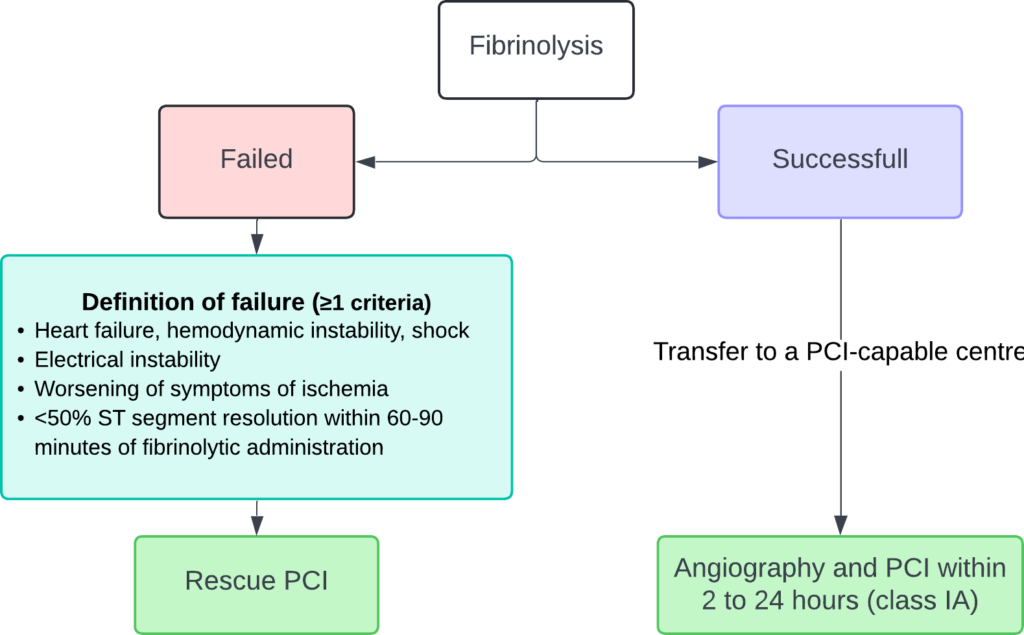
Fibrinolys (tenekteplas, alteplas, reteplas) är mycket effektivt för att lösa upp en trombos om det administreras tidigt (inom 2 timmar efter symtomdebut). Effekten av dessa medel avtar gradvis på grund av en omorganisation av trombosmaterialet. Om fibrinolys administreras pre-hospitalt kan det vara lika effektivt som PCI. Dock är risken för reocklusion relativt hög, och dessutom kan fibrinolys orsaka allvarliga blödningar. I Sverige ges fibrinolys endast när PCI inte är tillgängligt inom 120 minuter.
Fibrinolys anses vara misslyckad om ST-höjningarna inte minskar med 50% inom 60 minuter. I sådana fall bör rescue-PCI övervägas (Figur 15).
Absoluta kontraindikationer för fibrinolys
- Tidigare cerebral blödning
- Stroke av okänd typ
- Ischemisk stroke under de senaste 6 månaderna
- Tumörer eller skador i centrala nervsystemet
- Arteriovenös missbildning i centrala nervsystemet
- Aortadissektion
- Nyligen genomgången kirurgi/trauma (inom 3 veckor)
- Gastrointestinal blödning inom 4 veckor
- Koagulationsrubbningar
- Lumbalpunktion, leverbiopsi eller liknande ingrepp inom 24 timmar
Relativa kontraindikationer för fibrinolys
- Transitorisk ischemisk attack (TIA) inom 6 månader
- Pågående behandling med orala antikoagulantia
- Graviditet eller 1 vecka postpartum
- Refraktär hypertoni (systoliskt blodtryck >180 mmHg och/eller diastoliskt blodtryck >110 mmHg)
- Svår leversjukdom
- Infektiös endokardit
- Aktivt ulcus
- Långvarig eller traumatisk hjärt-lungräddning
Koronar bypasskirurgi (CABG)
CABG har en begränsad roll under den akuta fasen av STEMI. CABG bör dock övervägas om:
- PCI misslyckas
- Koronar anatomi inte är lämplig för PCI
- Mekaniska komplikationer (t.ex. ruptur av hjärtväggen) uppstår
- Kardiogen chock föreligger.
Referenser
1. Ducas, J., et al. “Outcomes of a Pre-Hospital Diagnosis and Catheter Laboratory Activation Program for ST Elevation Myocardial Infarction.” Journal of the American College of Cardiology, vol. 53, no. 4, 2009, pp. 246–252.
2. Mencl, F., et al. “EMS Provider and Physician Interpretation of Electrocardiograms in ST-Elevation Myocardial Infarction.” Prehospital Emergency Care, vol. 16, no. 3, 2012, pp. 378–382.
3. Sgarbossa, E. B., et al. “Electrocardiographic Diagnosis of Evolving Acute Myocardial Infarction in the Presence of Left Bundle-Branch Block.” The New England Journal of Medicine, vol. 334, no. 8, 1996, pp. 481–487.
4. Smith, S. W., et al. “Diagnosis of ST-Elevation Myocardial Infarction in the Presence of Left Bundle Branch Block with the ST-Elevation to S-Wave Ratio in a Modified Sgarbossa Rule.” Annals of Emergency Medicine, vol. 60, no. 6, 2012, pp. 766–776.
5. Hoedemaker, G., et al. “Reduction of Myocardial Infarct Size by Early Treatment with Beta-Adrenergic Blockade.” The New England Journal of Medicine, vol. 301, no. 7, 1979, pp. 337–342.
6. Bangalore, S., et al. “β-Blocker Use and Clinical Outcomes in Stable Outpatients with and without Coronary Artery Disease.” JAMA, vol. 308, no. 13, 2012, pp. 1340–1349.
7. O’Gara, P. T., et al. “2013 ACCF/AHA Guideline for the Management of ST-Elevation Myocardial Infarction: Executive Summary.” Journal of the American College of Cardiology, vol. 61, no. 4, 2013, pp. 485–510.
8. Byrne, R. A., et al. “2018 ESC/EACTS Guidelines on Myocardial Revascularization.” European Heart Journal, vol. 39, no. 2, 2018, pp. 87–165.
9. Yndigegn, T., et al. “Efficacy of Long-Term β-Blocker Therapy for Secondary Prevention Following Myocardial Infarction in the Era of Percutaneous Coronary Intervention: A Meta-Analysis.” European Heart Journal, vol. 38, no. 2, 2017, pp. 103–112.
10. Schüpke, S., et al. “Ticagrelor or Prasugrel in Patients with Acute Coronary Syndromes.” The New England Journal of Medicine, vol. 381, no. 16, 2019, pp. 1524–1534.
11. Wiviott, S. D., et al. “Prasugrel versus Clopidogrel in Patients with Acute Coronary Syndromes.” The New England Journal of Medicine, vol. 357, no. 20, 2007, pp. 2001–2015.
12. Niezgoda, P., et al. “Prehospital Administration of P2Y12 Receptor Inhibitors in ST-Segment Elevation Myocardial Infarction: A Meta-Analysis.” Journal of Thrombosis and Thrombolysis, vol. 44, no. 4, 2017, pp. 489–498.
13. Dawson, L. P., et al. “Pre-Treatment with P2Y12 Inhibitors in ST-Elevation Myocardial Infarction: A Systematic Review and Meta-Analysis.” Heart, vol. 106, no. 1, 2020, pp. 20–26.
14. Morrow, D. A., Antman, E. M., Charlesworth, A., Cairns, R., Murphy, S. A., de Lemos, J. A., Giugliano, R. P., McCabe, C. H., & Braunwald, E. (2000). TIMI risk score for ST-elevation myocardial infarction: A convenient, bedside, clinical score for risk assessment at presentation: An intravenous nPA for treatment of infarcting myocardium early II trial substudy. Circulation, 102(17), 2031–2037.
15. Gulati, M., Levy, P. D., Mukherjee, D., Amsterdam, E., Bhatt, D. L., Birtcher, K. K., Blankstein, R., Boyd, J., Bullock-Palmer, R. P., Conejo, T., Diercks, D. B., Gentile, F., Greenwood, J. P., Hess, E. P., Hollenberg, S. M., Jaber, W. A., Jneid, H., Joglar, J. A., Morrow, D. A., O’Connor, R. E., Ross, M. A., & Shaw, L. J. (2021). 2021 AHA/ACC/ASE/CHEST/SAEM/SCCT/SCMR Guideline for the Evaluation and Diagnosis of Chest Pain: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation, 144(22), e368–e454.
16. Granger, C. B., Goldberg, R. J., Dabbous, O., Pieper, K. S., Eagle, K. A., Cannon, C. P., Van de Werf, F., Avezum, A., Goodman, S. G., Flather, M. D., & Fox, K. A. A. (2003). Predictors of hospital mortality in the Global Registry of Acute Coronary Events. Archives of Internal Medicine, 163(19), 2345–2353.
17. Fox, K. A. A., Dabbous, O. H., Goldberg, R. J., Pieper, K. S., Eagle, K. A., Van de Werf, F., Avezum, A., Goodman, S. G., Flather, M. D., Anderson, F. A., & Granger, C. B. (2006). Prediction of risk of death and myocardial infarction in the six months after presentation with acute coronary syndrome: prospective multinational observational study (GRACE). BMJ, 333(7578), 1091.
18. Eagle, K. A., Lim, M. J., Dabbous, O. H., Pieper, K. S., Goldberg, R. J., Van de Werf, F., Goodman, S. G., Granger, C. B., Steg, P. G., Gore, J. M., Budaj, A., Avezum, A., Flather, M. D., & Fox, K. A. A. (2004). A validated prediction model for all forms of acute coronary syndrome: estimating the risk of 6-month postdischarge death in an international registry. JAMA, 291(22), 2727–2733.
19. Thygesen, K., Alpert, J. S., Jaffe, A. S., Chaitman, B. R., Bax, J. J., Morrow, D. A., & White, H. D. (2018). Fourth Universal Definition of Myocardial Infarction (2018). Circulation, 138(20), e618–e651.
20. Reed, G. W., Rossi, J. E., & Cannon, C. P. (2017). Acute myocardial infarction. The Lancet, 389(10065), 197–210.
21. Anderson, J. L., & Morrow, D. A. (2017). Acute myocardial infarction. The New England Journal of Medicine, 376(21), 2053–2064.

